Generický název: lidocaine hydrochloride
Dávkovací forma: perorální roztok
Pouze na lékařský předpis
Místní anestetikum pro sliznice úst a hltanu.
Po uvedení na trh byly hlášeny případy křečí, kardiopulmonální zástavy a úmrtí u pacientů mladších 3 let při použití přípravku Lidocaine Viscous 2%, pokud nebyl podáván při přísném dodržování doporučení pro dávkování a podávání. V případě bolesti při prořezávání zubů by se přípravek Lidocaine Viscous 2% obecně neměl používat. U ostatních stavů by mělo být použití přípravku u pacientů mladších 3 let omezeno na situace, kdy nejsou k dispozici bezpečnější alternativy nebo byly vyzkoušeny, ale selhaly.
Pro snížení rizika závažných nežádoucích účinků při použití přípravku Lidocaine Viscous 2% poučte pečovatele, aby přísně dodržovali předepsanou dávku a frekvenci podávání a uchovávali předepsanou lahvičku bezpečně mimo dosah dětí.
- POPIS
- Lidokain topický perorální roztok – klinická farmakologie
- Mechanismus účinku
- Hemodynamika
- Farmakokinetika a metabolismus
- Indikace a použití přípravku Lidocaine Topical Oral Solution
- Kontraindikace
- Upozornění
- Život ohrožující a smrtelné příhody u kojenců a malých dětí
- Methemoglobinemie
- Poučení
- Informace pro pacienty
- Všeobecné informace
- Lékové interakce
- Karcinogeneze, mutageneze, poškození plodnosti
- Těhotenství
- Kojící matky
- Podávání dětem
- Nežádoucí účinky
- Centrální nervový systém
- Předávkování
- Řízení mimořádných událostí způsobených lokálními anestetiky
- DÁVKOVÁNÍ A ZPŮSOB PODÁVÁNÍ
- Dospělí
- Pediatrické
- Jak se přípravek dodává
- Panel na obalu/etiketě
- Panel na obalu/etiketě
POPIS
Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) obsahuje lokální anestetikum a podává se lokálně. Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP) obsahuje lidocaine hydrochloride, který je chemicky označován jako acetamid, 2-(diethylamino)-N-(2,6-dimethylfenyl)-,monohydrochlorid a má následující strukturní vzorec:
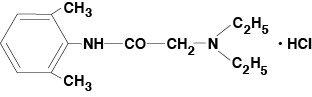
Molekulární vzorec lidocainu je C14H22N2O. Molekulová hmotnost je 234,34.
Složení roztoku:
Každý ml obsahuje 20 mg (2 %) lidocaine hydrochloride USP a následující neaktivní složky: sodnou sůl karboxymethylcelulosy, aroma, methylparaben, propylparaben, čištěnou vodu a sodnou sůl sacharinu.
Lidokain topický perorální roztok – klinická farmakologie
Mechanismus účinku
Lidokain stabilizuje neuronální membránu inhibicí iontových toků nutných pro iniciaci a vedení impulzů, čímž působí lokálně anesteticky.
Hemodynamika
Překročení hladiny v krvi může způsobit změny srdečního výdeje, celkového periferního odporu a středního arteriálního tlaku. Tyto změny mohou být způsobeny přímým tlumivým účinkem lokálního anestetika na různé složky kardiovaskulárního systému. Čistým účinkem je obvykle mírná hypotenze, pokud nejsou překročeny doporučené dávky.
Farmakokinetika a metabolismus
Lidokain se absorbuje po lokálním podání na sliznice, přičemž rychlost a rozsah jeho absorpce závisí na koncentraci a celkové podané dávce, specifickém místě aplikace a délce expozice. Obecně platí, že k rychlosti absorpce lokálních anestetik po lokální aplikaci dochází nejrychleji po intratracheálním podání. Lidokain se také dobře vstřebává z gastrointestinálního traktu, ale v důsledku biotransformace v játrech se v oběhu objevuje jen málo intaktního léčiva. Vazba lidokainu v plazmě je závislá na koncentraci léčiva a s rostoucí koncentrací se vázaná frakce snižuje. Při koncentracích 1 až 4 mcg volné báze na ml je 60 až 80 % lidokainu vázáno na bílkoviny. Vazba je také závislá na plazmatické koncentraci alfa-1-kyselého glykoproteinu.
Lidokain prochází hematoencefalickou a placentární bariérou pravděpodobně pasivní difuzí.
Lidokain je rychle metabolizován játry a metabolity a nezměněné léčivo jsou vylučovány ledvinami. Biotransformace zahrnuje oxidativní N-dealkylaci, kruhovou hydroxylaci, štěpení amidové vazby a konjugaci. N-dealkylace, hlavní cesta biotransformace, poskytuje metabolity monoethylglycinexylidid a glycinexylidid. Farmakologické/toxikologické účinky těchto metabolitů jsou podobné, ale méně silné než u lidokainu. Přibližně 90 % podaného lidokainu se vylučuje ve formě různých metabolitů a méně než 10 % se vylučuje v nezměněné formě. Primárním metabolitem v moči je konjugát 4-hydroxy-2,6-dimethylanilinu.
Eliminační poločas lidokainu po intravenózní bolusové injekci je obvykle 1,5 až 2 hodiny. Vzhledem k rychlé rychlosti, kterou je lidokain metabolizován, může jakýkoli stav, který ovlivňuje funkci jater, změnit kinetiku lidokainu. U pacientů s poruchou funkce jater může být poločas prodloužen dvakrát nebo vícekrát. Porucha funkce ledvin neovlivňuje kinetiku lidokainu, ale může zvýšit akumulaci metabolitů.
Faktory jako acidóza a užívání stimulancií a depresiv CNS ovlivňují hladiny lidokainu v CNS potřebné k vyvolání zjevných systémových účinků. Objektivní nežádoucí projevy jsou stále zřetelnější se zvyšující se hladinou ve venózní plazmě nad 6 mcg volné báze na ml. U opice rhesus bylo prokázáno, že hladiny v arteriální krvi 18 až 21 mcg/ml jsou prahem pro konvulzivní aktivitu.
Indikace a použití přípravku Lidocaine Topical Oral Solution
Lidokain je indikován k vyvolání lokální anestezie podrážděných nebo zanícených sliznic úst a hltanu. Je také vhodný ke snížení dávení při pořizování rentgenových snímků a zubních otisků.
Kontraindikace
Lidokain je kontraindikován u pacientů se známou přecitlivělostí na lokální anestetika amidového typu nebo na jiné složky roztoku.
Upozornění
EXCESIVNÍ DÁVKOVÁNÍ NEBO KRÁTKÉ INTERVALY MEZI DÁVKAMI MOHOU MÍT ZA NÁSLEDEK VYSOKÉ HODNOTY PLAZMY A VÁŽNÉ NEŽÁDOUCÍ ÚČINKY. PACIENTI BY MĚLI BÝT POUČENI, ABY PŘÍSNĚ DODRŽOVALI DOPORUČENÉ DÁVKOVÁNÍ A POKYNY PRO PODÁVÁNÍ, JAK JE UVEDENO V TÉTO PŘÍBALOVÉ INFORMACI. ŘEŠENÍ ZÁVAŽNÝCH NEŽÁDOUCÍCH ÚČINKŮ MŮŽE VYŽADOVAT POUŽITÍ RESUSCITAČNÍCH PŘÍSTROJŮ, OXYGENU A JINÝCH RESUSCITAČNÍCH LÁTEK.
Lidokain by měl být používán s mimořádnou opatrností, pokud byla sliznice v místě aplikace traumatizována, protože za takových podmínek existuje možnost rychlé systémové absorpce.
Život ohrožující a smrtelné příhody u kojenců a malých dětí
Po uvedení na trh byly hlášeny případy křečí, kardiopulmonální zástavy a úmrtí u pacientů mladších 3 let při použití přípravku Lidocaine Viscous 2%, pokud nebyl podáván při přísném dodržování doporučení pro dávkování a podávání. V případě bolesti při prořezávání zubů by se přípravek Lidocaine Viscous 2% obecně neměl používat. U ostatních stavů by mělo být použití přípravku u pacientů mladších 3 let omezeno na situace, kdy nejsou k dispozici bezpečnější alternativy nebo byly vyzkoušeny, ale selhaly.
Methemoglobinemie
V souvislosti s použitím lokálních anestetik byly hlášeny případy methemoglobinemie. Ačkoli jsou methemoglobinémií ohroženi všichni pacienti, pacienti s deficitem glukózo-6-fosfátdehydrogenázy, vrozenou nebo idiopatickou methemoglobinémií, srdeční nebo plicní kompromitací, kojenci mladší 6 měsíců a současnou expozicí oxidačním látkám nebo jejich metabolitům jsou náchylnější k rozvoji klinických projevů tohoto stavu. Pokud je u těchto pacientů nutné použít lokální anestetika, doporučuje se pečlivé sledování příznaků a projevů methemoglobinemie.
Příznaky methemoglobinemie se mohou objevit okamžitě nebo se mohou opozdit o několik hodin po expozici a jsou charakterizovány cyanotickým zbarvením kůže a/nebo abnormálním zbarvením krve. Hladiny methemoglobinu mohou dále stoupat, proto je nutná okamžitá léčba, aby se předešlo závažnějším nežádoucím účinkům na centrální nervový systém a kardiovaskulární systém, včetně záchvatů, kómatu, arytmií a smrti. Přerušte podávání přípravku Lidocaine Viscous 2% a všech dalších oxidačních látek. V závislosti na závažnosti příznaků a symptomů mohou pacienti reagovat na podpůrnou péči, tj. kyslíkovou terapii, hydrataci. Závažnější klinický obraz může vyžadovat léčbu methylenovou modří, výměnnou transfuzi nebo hyperbarický kyslík.
Poučení
Informace pro pacienty
Rodiče a pečovatele je třeba upozornit na následující:
– U pacientů mladších 3 let je třeba věnovat zvláštní pozornost přesnému odměření předepsané dávky a nepodávat přípravek častěji, než je předepsáno. – K zajištění přesnosti doporučujeme používat měřící zařízení k pečlivému odměření správného objemu. – Přípravek by měl být používán pouze pro předepsanou indikaci. – Aby se snížilo riziko náhodného požití, měl by být obal přípravku těsně uzavřen a přípravek by měl být ihned po každém použití uložen mimo dosah všech dětí. – Pokud pacient vykazuje známky systémové toxicity (např. letargie, mělké dýchání, záchvatovitá aktivita), je třeba okamžitě vyhledat lékařskou pomoc a nepodávat další přípravek. – Nepoužitý přípravek by měl být zlikvidován způsobem, který zabrání možné expozici dětí a domácích zvířat.
Všichni pacienti by si měli být vědomi, že při použití lokálních anestetik v ústech nebo v krku může tvorba lokální anestezie zhoršit polykání a tím zvýšit nebezpečí aspirace. Z tohoto důvodu by se po dobu 60 minut po použití lokálních anestetických přípravků v oblasti úst nebo krku neměla přijímat potrava. To je důležité zejména u dětí vzhledem k jejich častému příjmu potravy.
Nemoc jazyka nebo bukální sliznice může zvýšit nebezpečí kousacího traumatu. Z tohoto důvodu by se během anestezie v oblasti úst nebo krku nemělo používat jídlo a/nebo žvýkačky.
Informujte pacienty, že použití lokálních anestetik může způsobit methemoglobinémii, což je závažný stav, který musí být okamžitě léčen. Doporučte pacientům nebo ošetřovatelům, aby okamžitě vyhledali lékařskou pomoc, pokud se u nich nebo u někoho v jejich péči objeví následující příznaky nebo symptomy: bledá, šedě nebo modře zbarvená kůže (cyanóza), bolest hlavy, zrychlená srdeční frekvence, dušnost, závratě nebo únava.
Všeobecné informace
Bezpečnost a účinnost lidokainu závisí na správném dávkování, správné technice, přiměřených bezpečnostních opatřeních a připravenosti pro případ nouze (viz Upozornění a NEŽÁDOUCÍ REAKCE). Je třeba použít nejnižší dávku, která vede k účinné anestezii, aby se zabránilo vysokým plazmatickým hladinám a závažným nežádoucím účinkům. Opakované dávky lidokainu mohou způsobit významné zvýšení hladin v krvi s každou opakovanou dávkou z důvodu pomalé akumulace léčiva a/nebo jeho metabolitů. Tolerance se liší podle stavu pacienta. Oslabeným, starším pacientům, akutně nemocným pacientům a dětem by měly být podávány snížené dávky odpovídající jejich věku, hmotnosti a fyzické kondici. Lidokain by měl být také používán s opatrností u pacientů s těžkým šokem nebo srdeční blokádou.
Lidokain by měl být používán s opatrností u osob se známou citlivostí na léky. U pacientů alergických na deriváty kyseliny paraaminobenzoové (prokain, tetrakain, benzokain atd.) nebyla prokázána zkřížená citlivost na lidokain.
Lékové interakce
Pacienti, kterým jsou podávána lokální anestetika, jsou vystaveni zvýšenému riziku vzniku methemoglobinémie při současném působení následujících léků, mezi které mohou patřit i jiná lokální anestetika:
Příklady léků spojených s methemoglobinémií:
|
Třída |
Příklady |
|
Nitráty/nitrity |
nitroglycerin, nitroprusid, oxid dusnatý, oxid dusný |
|
Lokální anestetika |
benzokain, lidokain, bupivakain, mepivakain, tetrakain, prilokain, prokain, artikain, ropivakain |
|
Antineoplastické látky |
cyklofosfamid, flutamid, rasburikas, ifosfamid, hydroxyurea |
|
Antibiotika |
dapson, sulfonamidy, nitrofurantoin, kyselina para-aminosalicylová |
|
Antimalarika |
chlorochin, primaquin |
|
Antikonvulziva |
fenytoin, valproát sodný, fenobarbital |
|
Ostatní léčiva |
acetaminofen, metoklopramid, sulfasalazin, chinin |
Karcinogeneze, mutageneze, poškození plodnosti
Studie lidokainu na zvířatech pro hodnocení karcinogenního a mutagenního potenciálu nebo vlivu na plodnost nebyly provedeny.
Těhotenství
Teratogenní účinky
Těhotenství Kategorie B: Reprodukční studie byly provedeny na potkanech v dávkách až 6,6krát vyšších než je dávka pro člověka a neodhalily žádné důkazy o poškození plodu způsobeném lidokainem. Neexistují však žádné adekvátní a dobře kontrolované studie u těhotných žen. Protože reprodukční studie na zvířatech ne vždy předpovídají reakci u lidí, měl by být tento léčivý přípravek v těhotenství používán pouze v případě jasné potřeby.
Kojící matky
Není známo, zda se tento léčivý přípravek vylučuje do lidského mléka. Protože se do lidského mléka vylučuje mnoho léčivých látek, je třeba při podávání lidokainu kojícím ženám dbát zvýšené opatrnosti.
Podávání dětem
Dávkování u dětí by mělo být sníženo, přiměřeně věku, tělesné hmotnosti a fyzickým podmínkám. Viz Dávkování a způsob podání.
Nežádoucí účinky
Nežádoucí zkušenosti po podání lidokainu jsou podobné povahy jako zkušenosti pozorované u jiných amidových lokálních anestetik. Tyto nežádoucí zkušenosti obecně souvisejí s dávkou a mohou být důsledkem vysokých plazmatických hladin způsobených nadměrnou dávkou nebo rychlou absorpcí, nebo mohou být důsledkem přecitlivělosti, idiosynkrazie nebo snížené tolerance ze strany pacienta. Závažné nežádoucí zkušenosti jsou obecně systémové povahy. Nejčastěji jsou hlášeny následující typy:
Centrální nervový systém
Projevy CNS jsou excitační a/nebo depresivní a mohou být charakterizovány závratěmi, nervozitou, obavami, euforií, zmateností, závratěmi, ospalostí, hučením v uších, rozmazaným nebo dvojitým viděním, zvracením, pocity horka, chladu nebo znecitlivění, záškuby, třesem, křečemi, bezvědomím, depresí a zástavou dechu. Excitační projevy mohou být velmi krátké nebo se nemusí objevit vůbec, v takovém případě může být prvním projevem toxicity ospalost přecházející v bezvědomí a zástavu dechu.
Ospalost po podání lidokainu je obvykle časným příznakem vysoké hladiny léčiva v krvi a může se objevit jako důsledek rychlé absorpce.
Kardiovaskulární systém
Kardiovaskulární projevy jsou obvykle depresivní a jsou charakterizovány bradykardií, hypotenzí a kardiovaskulárním kolapsem, který může vést k zástavě srdce.
Alergické
Alergické reakce jsou charakterizovány kožními lézemi, kopřivkou, edémem nebo anafylaktoidními reakcemi. Alergické reakce se mohou objevit v důsledku citlivosti buď na lokální anestetikum, nebo na methylparaben a/nebo propylparaben použitý v tomto přípravku. Alergické reakce v důsledku citlivosti na lidokain jsou velmi vzácné, a pokud se vyskytnou, měly by být řešeny běžnými prostředky. Zjištění citlivosti pomocí kožních testů má pochybnou hodnotu.
Předávkování
Akutní stavy nouze způsobené lokálními anestetiky obecně souvisejí s vysokými plazmatickými hladinami, které se vyskytují při terapeutickém použití lokálních anestetik. (Viz NEŽÁDOUCÍ REAKCE, UPOZORNĚNÍ a OPATŘENÍ)
Řízení mimořádných událostí způsobených lokálními anestetiky
Prvním hlediskem je prevence, které se nejlépe dosáhne pečlivým a neustálým sledováním kardiovaskulárních a respiračních vitálních funkcí a stavu vědomí pacienta po každém podání lokálního anestetika.
První krok při řešení křečí spočívá v okamžité pozornosti věnované udržení průchodných dýchacích cest a asistované nebo řízené ventilaci kyslíkem. V situacích, kdy je snadno dostupný vyškolený personál, by měla být udržována ventilace a kyslík by měl být dodáván pomocí dodávkového systému, který je schopen umožnit okamžitý pozitivní tlak v dýchacích cestách pomocí masky. Ihned po zavedení těchto ventilačních opatření by měla být vyhodnocena přiměřenost oběhu, přičemž je třeba mít na paměti, že léky používané k léčbě křečí někdy při intravenózním podání tlumí oběh. Pokud křeče přetrvávají i přes adekvátní podporu dýchání a pokud to stav oběhu dovoluje, lze intravenózně podat malé dávky ultrakrátce působícího barbiturátu (např. thiopental nebo thiamylal) nebo benzodiazepinu (např. diazepam). Lékař by měl být před použitím lokálních anestetik seznámen s těmito antikonvulzivy. Podpůrná léčba oběhové deprese může vyžadovat podání intravenózních tekutin a v případě potřeby vazopresor podle klinické situace (např. efedrin).
Pokud nejsou křeče i kardiovaskulární deprese okamžitě léčeny, mohou vyústit v hypoxii, acidózu, bradykardii, arytmie a srdeční zástavu. Pokud dojde k zástavě srdce, je třeba zahájit standardní kardiopulmonální resuscitační opatření.
Dialýza má při léčbě akutního předávkování lidokainem zanedbatelný význam.
Perorální LD50 lidokainu u samic potkanů bez příjmu potravy je 459 (346 až 773) mg/kg (jako sůl) a 214 (159 až 324) mg/kg (jako sůl) u samic potkanů bez příjmu potravy.
DÁVKOVÁNÍ A ZPŮSOB PODÁVÁNÍ
Dospělí
Maximální doporučená jednorázová dávka lidokainu pro zdravé dospělé osoby by měla být taková, aby dávka lidokainu nepřekročila 4 dávky.5 mg/kg nebo 2 mg/l tělesné hmotnosti a v žádném případě nepřekročí celkovou dávku 300 mg.
Pro symptomatickou léčbu podrážděných nebo zanícených sliznic úst a hltanu je obvyklá dávka pro dospělé 15 ml neředěného roztoku. Při použití v ústech je třeba roztok rozmáchnout v ústech a vyplivnout. Pro použití v hltanu by se měl neředěný roztok kloktat a může se spolknout. Tato dávka by neměla být podávána v intervalech kratších než tři hodiny a během 24 hodin by nemělo být podáno více než osm dávek. Dávkování by mělo být upraveno úměrně věku, hmotnosti a fyzické kondici pacienta (viz PRECAUTIONS).
Pediatrické
U všech dětských pacientů je třeba dbát na správné dávkování, protože byly zaznamenány případy předávkování v důsledku nevhodného dávkování.
Je obtížné doporučit maximální dávku jakéhokoli léku pro děti, protože ta se mění v závislosti na věku a hmotnosti. U dětí starších 3 let, které mají normální libovou tělesnou hmotnost a normální tělesný vývoj, se maximální dávka určuje podle hmotnosti nebo věku dítěte. Například: u dítěte ve věku 5 let vážícího 50 kg by dávka lidokainu neměla překročit 75 až 100 mg (3,7 až 5 ml lidokainu).
U kojenců a u dětí mladších 3 let by měl být roztok přesně odměřen a do bezprostřední oblasti by se nemělo aplikovat více než 1,2 ml pomocí aplikátoru s vatovou špičkou. Před podáním další dávky vyčkejte nejméně 3 hodiny; během 12 hodin lze podat maximálně čtyři dávky. Lidokain by měl být použit pouze v případě, že základní onemocnění vyžaduje léčbu objemem přípravku, který je menší nebo roven 1,2 ml.
Jak se přípravek dodává
Lidocaine Viscous 2% (Lidocaine Hydrochloride Oral Topical Solution USP)
Perorální topický roztok 2% se dodává jako čirý, bezbarvý, viskózní roztok.
NDC 0054-0548-44: Stlačovací lahvička po 20 ml
NDC 0054-3500-49: Stlačovací lahvička po 100 ml
Uchovávejte při teplotě 20° až 25°C.
Dávkujte do nádoby odolné proti otevření dětmi, jak je definováno v USP/NF.
PŘED POUŽITÍM DOBŘE VYTVOŘTE.
Distribuce do:
Farmaceuticals Corp.
Eatontown, NJ 07724
Revidováno říjen 2018
Panel na obalu/etiketě
NDC 0054-3500-49 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 100ml

Panel na obalu/etiketě
NDC 0054-0548-.44 Lidocaine Viscous (Lidocaine Hydrochloride Oral Topical Solution USP) 15ml

| LIDOCAINE VISCOUS roztok hydrochloridu lidokainu |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
| LIDOCAINE VISCOUS lidocaine hydrochloride roztok |
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
|
||||||||||||||
Označovatel – West-Ward Pharmaceuticals Corp. (080189610)
| Zařízení | |||
| Název | Adresa | ID/FEI | Provoz |
| West-Ward Columbus Inc. | 058839929 | MANUFACTURE(0054-3500, 0054-0548) | |
Medical Disclaimer
.