Obsah
- 1 Funkce
- 2 Lidská laktátdehydrogenáza
- 2.1 Struktura
- 2.2 Katalýza
- 2.3 Kinetika
- 2.4 Regulace
- 3 3D struktury laktátdehydrogenázy
Funkce
L-laktátdehydrogenáza (L-LDH) katalyzuje přeměnu pyruvátu a NADH+ na L-laktát a NAD+.
H-laktátdehydrogenáza (H-LDH) katalyzuje interkonverzi D-laktátu a ferricytochromu c na pyruvát a ferrocytochrom c.
Laktátdehydrogenáza (LDH) je důležitý enzym u lidí. Vyskytuje se v různých oblastech těla, přičemž každá oblast má jedinečnou konformaci různých podjednotek. LDH je klíčovým enzymem při anaerobním dýchání. Anaerobní dýchání probíhá za nepřítomnosti kyslíku. Tato dráha je důležitá pro glykolýzu ve dvou hlavních směrech. První spočívá v tom, že pokud by se pyruvát hromadil v glykolýze, a tím by se zpomalila tvorba ATP. Druhým je, že anaerobní dýchání umožňuje regeneraci NAD+ z NADH. NAD+ je zapotřebí, když glyceraldehyd-3-fosfát dehydrogenáza oxiduje glyceraldehyd-3-fosfát při glykolýze, při níž vzniká NADH. Laktátdehydrogenáza je zodpovědná za anaerobní přeměnu NADH na NAD+. v Laktátdehydrogenáza z Cryptosporidium parvum (4nd4).
Lidská laktátdehydrogenáza
Struktura
je kvartérní protein tvořený kombinací dvou podjednotek M a H (svalová a srdeční) do struktury čtyř podjednotek. V lidském těle se vyskytují tyto různé kombinace:
- (4H) Srdce
- (3H1M) Retikuloendoteliální
- (2H2M) Plíce
- (1H3M) Ledviny
- (4M) Svaly a játra
Z LDH, jak je zde uvedeno, se skládá 40 % alfa šroubovic a 23 % beta listů. Údaje SCOP klasifikují tuto formu laktátdehydrogenázy jako smíšenou beta-alfa-beta s převážně paralelními beta listy.
Viz také
- Lidská laktátdehydrogenáza
- Jasperova laktátová finální
- Rossmannova složka.
Katalýza
Studie ukázaly, že reakční mechanismus LDH sleduje uspořádanou posloupnost.
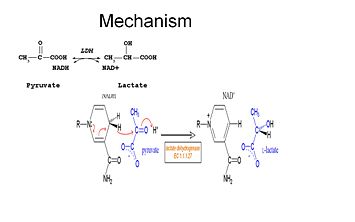
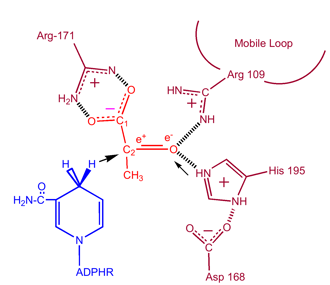
Aby mohl být laktát oxidován, musí se na enzym nejprve navázat NADH a poté laktát. . Jakmile je NADH navázán na enzym, je možné, aby se na něj navázal laktát (zobrazen substrát oxamát; skupina -CH3 je nahrazena skupinou -NH2 za vzniku oxamátu). Laktát se váže na enzym mezi nikotinamidový kruh a několik zbytků LDH. Poté dojde k rychlému přenosu hydridového iontu v obou směrech, čímž vznikne směs dvou terciárních komplexů, enzym-NAD+-laktát a enzym-NADH-pyruvát.Nakonec pyruvát disociuje od enzymu a následně NAD+.
Kinetika
Kinetické studie laktátdehydrogenázy s oxalátem a oxamátem (strukturními analogy laktátu a pyruvátu)prokázaly výše uvedený mechanismus. Rychlost limitujícím krokem v této reakci je rychlost disociace NAD+ a NADH. Přeměna pyruvátu na laktát s následnou regenerací NAD+ je velmi příznivá.
Regulace
Jelikož se jedná o rovnovážný mechanismus, zdá se, že pro laktátdehydrogenázu není speciálně určena žádná regulace, místo toho je závislá na aktivaci anaerobní reparace a přítomnosti pyruvátu a NADH nebo laktátu a NAD+.
3D struktury laktátdehydrogenázy
3D struktury laktátdehydrogenázy
.
