Atomy mohou získávat nebo ztrácet elektrony za vzniku iontů v procesu zvaném ionizace (takto vzniklé sloučeniny se nazývají iontové). Když se iontové sloučeniny rozpouštějí ve vodě, jejich ionty se od sebe oddělují v procesu zvaném disociace. Zajímavou vlastností vody a mnoha dalších kovalentních sloučenin je, že i ony mohou disociovat na ionty. Na rozdíl od iontových sloučenin, jako je chlorid sodný, nejsou před disociací ionizovány; ionizace a disociace u nich probíhá současně.
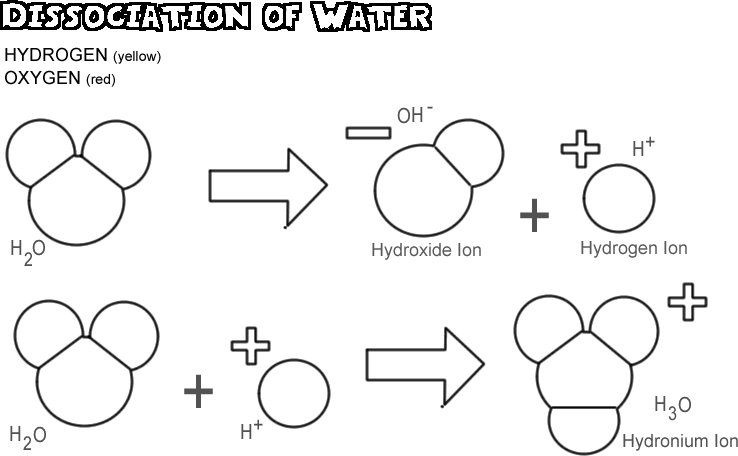
Disociace vody
Při disociaci vody jedno z jader vodíku opustí svůj elektron spolu s atomem kyslíku a stane se vodíkovým iontem, zatímco kyslík a ostatní atomy vodíku se stanou hydroxidovým iontem. Protože vodíkový iont nemá žádný elektron, který by neutralizoval kladný náboj jeho protonu, má plnou jednotku kladného náboje a symbolizuje se jako H+. Hydroxidový iont si ponechává elektron, který mu zůstal, a má tedy plnou jednotku záporného náboje, symbolizovanou OH-. Vodíkový iont (proton) se sám dlouho nepotuluje, než se připojí k atomu kyslíku druhé neionizované molekuly vody a vytvoří hydroniový iont (H3O+)
V každém vzorku vody je v jednom okamžiku disociováno jen velmi málo molekul: ve skutečnosti jen asi jedna z 550 milionů. Dochází však k neustálým změnám; když se jeden vodíkový iont znovu připojí k hydroxidovému iontu a vytvoří molekulu vody, disociuje jiná molekula vody, která nahradí vodíkový iont a hydroxidový iont v roztoku.
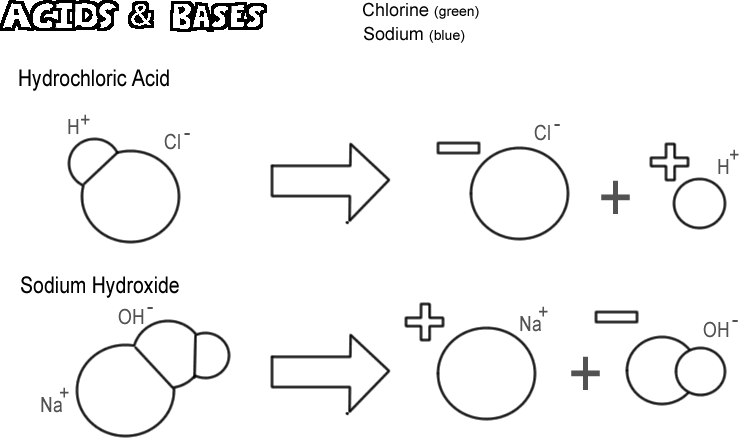
Kyselina chlorovodíková
Některé molekuly, iontové i kovalentní, disociují tak, že uvolňují vodíkový iont, aniž by se uvolnil hydroxidový iont. Tyto látky se nazývají kyseliny. Protože vodíkový iont je ve většině případů ve skutečnosti jen jeden proton, chemická definice kyseliny zní „donor protonu“. Pokud je „dárcem“ velmi mnoho protonů (vodíkových iontů), může být účinek velmi silný, například pálení kůže nebo rozpouštění kovů. Kyselinou na obrázku je kyselina chlorovodíková. Čistá kyselina chlorovodíková je plyn, ale snadno se rozpouští ve vodě za vzniku roztoku vodíkových a chloridových iontů. Protože je téměř celá disociována ve vodě, nazývá se silnou kyselinou. Kyseliny, které nedisociují úplně, se nazývají slabé kyseliny.
Hydroxid sodný
Opakem kyseliny je zásada, známá také jako zásada. Typickou silnou zásadou je hydroxid sodný, hlavní složka louhu. Hydroxid sodný disociuje za vzniku sodného iontu a hydroxidového iontu. Zásada je definována jako „akceptor protonů“. Nejběžnější zásady vytvářejí při disociaci hydroxidový ion a právě hydroxidový ion přijímá proton. Silná zásada může způsobit mnohem horší popálení kůže než kyselina.
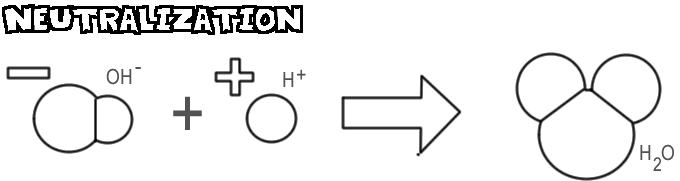
Neutralizace
Při smíchání zásady a kyseliny se hydroxidový ion a zásada spojí s vodíkovým iontem z kyseliny za vzniku vody. Tento proces se nazývá neutralizace.
Otázky:
1. Co je to neutralizace? Co se stane, když atom získá nebo ztratí elektron?