Výroba energie z obnovitelných zdrojů ne vždy odpovídá poptávce. Je to z prostého důvodu, že spotřebitelé mohou chtít využívat energii, když nesvítí slunce nebo nefouká vítr. K vyrovnání tohoto problému výroby a poptávky lze použít baterie. Baterie se mohou nabíjet, když se energie vyrábí, a vybíjet, když je energie potřeba.
Baterie mohou také dělat mnohem více než jen vyrovnávat výrobu energie a poptávku. Baterie mohou pomoci s rozsáhlou škálou síťových aplikací, včetně záložních služeb, generování syntetické setrvačnosti a přeměny nesynchronní energie na synchronní. To všechno jsou služby, které jsou nezbytné pro spolehlivý provoz elektrické sítě.
Jak tedy baterie fungují?
Baterie mají tři klíčové části:
- kladnou elektrodu;
- zápornou elektrodu a
- elektrolyt, který elektrody odděluje.
Různé elektrody a elektrolyty vyvolávají různé chemické reakce, které ovlivňují fungování baterie. Proto je na trhu a ve vývoji velká rozmanitost baterií. Mezi různé vlastnosti baterií patří:
- velikost;
- kapacita;
- rychlost odezvy;
- rychlost nabíjení;
- životnost;
- bezpečnost;
- náklady a
- recyklovatelnost.
Vanadová redoxní baterie (VRB) je jednou z nejnovějších baterií, které se objevily na komerčním trhu. Je obzvláště slibná díky své extrémně velké akumulační kapacitě. Z hlediska ochrany životního prostředí je VRB rovněž slibná. VRB neprodukuje odpadní produkty a má dlouhou životnost. Chemikálie ve VRB není třeba vyměňovat a lze je používat donekonečna. Je třeba vyměnit pouze pouzdro a hardware VRB. Dlouhá životnost také znamená, že VRB má potenciál být levnou alternativou k jiným možnostem.
VRB má pozitivní a negativní komoru oddělenou membránou. Kladná komora má kladnou elektrodu a záporná komora má zápornou elektrodu. V obou komorách cirkulují vanadové elektrolyty: – kladný vanadový elektrolyt nebo druh v kladné komoře a záporný druh v záporné komoře. Komory jsou připojeny k zásobním nádržím, aby bylo možné čerpat velké objemy vanadových elektrolytů a cirkulovat je ve všech komorách. Membrána zabraňuje mísení kladných a záporných elektrolytů, ale umožňuje průchod iontů (atomů s kladným nebo záporným nábojem).
Při nabíjení a vybíjení VRB dochází současně k oxidaci a redukci vanadových druhů a k přenosu elektronů přes membránu. Oxidačně-redukční reakce je známá jako redoxní reakce. Při redukci dochází k získávání elektronů. Oxidace zahrnuje ztrátu elektronů. Během nabíjení se elektrolyt v kladné komoře oxiduje a elektrolyt v záporné komoře se redukuje. Při vybíjení je proces obrácený a elektrolyt v kladné komoře se redukuje, zatímco elektrolyt v záporné komoře se oxiduje.
Nabíjecí redoxní reakce může být použita k ukládání elektřiny, když je vyrobena, a vybíjecí redoxní reakce může dodávat elektřinu, když je požadována. VRB má účinnost nabíjení / vybíjení 75-80 %.
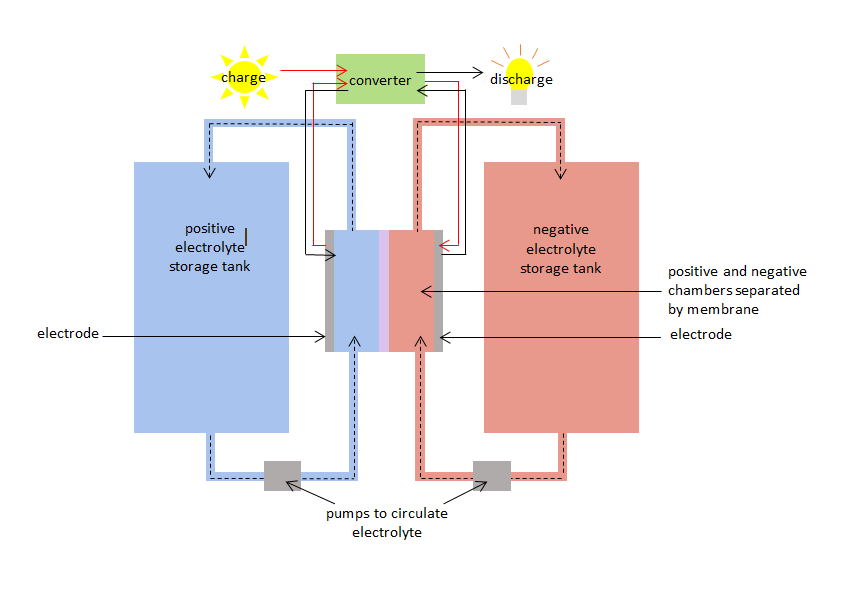
Diagram vanadové redoxní baterie
.