- Tabulka geometrií
- CÍLE UČENÍ
- Klíčové body
- Klíčové body
- Klíčové pojmy
- Model VSEPR
- Molekulární geometrie
- Jak určit molekulovou geometrii – YouTube:
- Molekulární geometrie
- CÍLE UČENÍ
- Klíčové body
- Klíčové body
- Klíčové pojmy
- Metoda AXE
- Hlavní geometrie (bez osamělých elektronových párů):
- Trigonální planární
- Tetrahedrální
- Oktaedrická
- Interaktivní: Elektronová geometrie: Molekuly nabývají různých tvarů díky vzorcům sdílených a nesdílených elektronů. V těchto příkladech jsou všechny elektrony ovlivňující tvar molekul sdílené v kovalentních vazbách, které drží atomy pohromadě a tvoří molekuly.
- Samostatné elektronové páry
- CÍLE UČENÍ
- Klíčové body
- Klíčové body
- Klíčové pojmy
- Molekulární geometrie s osamělými páry elektronů
- Koordinační číslo a centrální atom
- Odpudivý účinek osamělého páru elektronů
- Interaktivní: Nesdílené elektrony a „ohnutý“ tvar:
- LICENCE A PŘÍSLUŠENSTVÍ
- LICENCOVANÝ OBSAH, SDÍLENÝ PŘEDEM
- CC LICENCOVANÝ OBSAH, ZVLÁŠTNÍ PŘÍSLUŠENSTVÍ
Tabulka geometrií
Teorie VSEPR určuje molekulární geometrie (lineární, trigonální, trigonální bipyramidální, tetraedrické a oktaedrické).
CÍLE UČENÍ
Použijte model VSEPR k určení geometrie molekuly, která neobsahuje osamělé páry elektronů na centrálním atomu.
Klíčové body
Klíčové body
- V zásadě VSEPR model teoreticky předpokládá, že oblasti se záporným elektrickým nábojem se budou vzájemně odpuzovat, což způsobí, že zůstanou (a chemické vazby, které tvoří) co nejdále od sebe.
- Molekulární geometrie zohledňuje počet atomů a počet osamělých elektronových párů.
- Hlavní geometrie bez osamělých párových elektronů jsou: lineární, trigonální, tetraedrická, trigonální bipyramidální a oktaedrická.
Klíčové pojmy
- Teorie VSEPR: chemický model používaný k předpovídání tvaru jednotlivých molekul na základě elektrostatického odpuzování elektronových párů
Model VSEPR
Model odpuzování elektronových párů ve valenčním obalu (VSEPR) se zaměřuje na vazebné a nevazebné elektronové páry přítomné ve vnějším (valenčním) obalu atomu, který se spojuje se dvěma nebo více dalšími atomy.
V zásadě model VSEPR teoreticky předpokládá, že tyto oblasti se záporným elektrickým nábojem se navzájem odpuzují, což způsobuje, že se (a chemické vazby, které vytvářejí) drží co nejdále od sebe. Proto se obě elektronová mračna obsažená v jednoduché trojatomové molekule ![]() budou rozprostírat v opačných směrech. Úhlové oddělení 180° umístí oba vazebné orbitaly co nejdále od sebe; očekáváme proto, že se obě chemické vazby budou rozšiřovat v opačných směrech, čímž vznikne lineární molekula.
budou rozprostírat v opačných směrech. Úhlové oddělení 180° umístí oba vazebné orbitaly co nejdále od sebe; očekáváme proto, že se obě chemické vazby budou rozšiřovat v opačných směrech, čímž vznikne lineární molekula.

 . Dva atomy X (v bílé barvě) jsou od sebe vzdáleny 180°.
. Dva atomy X (v bílé barvě) jsou od sebe vzdáleny 180°.Pokud centrální atom obsahuje také jeden nebo více párů nevazebných elektronů, budou se tyto další oblasti záporného náboje chovat podobně jako oblasti spojené s vazebnými atomy. Orbitaly obsahující různé vazebné a nevazebné páry ve valenční slupce budou vystupovat z centrálního atomu ve směrech, které minimalizují jejich vzájemné odpuzování. Pokud má centrální atom částečně obsazené d-orbitály, může být schopen pojmout pět nebo šest elektronových párů, které někdy tvoří tzv. rozšířený oktet.
Molekulární geometrie
Molekulární geometrie (lineární, trigonální, tetraedrická, trigonální bipyramidální a oktaedrická) jsou určeny teorií VSEPR. Tabulka geometrií pomocí teorie VSEPR může usnadnit kreslení a pochopení molekul. Tabulku molekulových geometrií najdete na prvním obrázku. Druhý obrázek slouží jako názorná pomůcka k tabulce.


Jak určit molekulovou geometrii – YouTube:
Molekulární geometrie
Teorie VSEPR popisuje pět hlavních tvarů jednoduchých molekul: lineární, trigonální planární, tetraedrický, trigonální bipyramidální a oktaedrický.
CÍLE UČENÍ
Použijte model VSEPR k určení geometrie molekul, jejichž centrální atom obsahuje jeden nebo více osamělých párů elektronů.
Klíčové body
Klíčové body
- Lineární: jednoduchá trojatomová molekula typu
 ; její dva vazebné orbitaly jsou od sebe vzdáleny 180°.
; její dva vazebné orbitaly jsou od sebe vzdáleny 180°. - Trigonální planární: trojúhelníková a v jedné rovině, s vazebnými úhly 120°.
- Tetraedrický: čtyři vazby na jednom centrálním atomu s vazebnými úhly 109,5°.
- Trigonální bipyramidální: pět atomů kolem centrálního atomu; tři v jedné rovině s vazebnými úhly 120° a dva na opačných koncích molekuly.
- Oktaedrický: šest atomů kolem centrálního atomu, všechny s vazebnými úhly 90°.
Klíčové pojmy
- Teorie VSEPR: model VSEPR (Valence Shell Electron Pair Repulsion) se používá k předpovědi tvaru jednotlivých molekul na základě míry elektrostatického odpuzování elektronových párů
Metoda AXE
Dalším způsobem, jak se dívat na geometrii molekul, je „metoda AXE“ počítání elektronů. A v AXE představuje centrální atom a má vždy implicitní index jedna; X představuje počet sigma vazeb mezi centrálním a vnějšími atomy (vícenásobné kovalentní vazby – dvojité, trojité atd. se počítají jako jedno X); a E představuje počet osamělých elektronových párů obklopujících centrální atom. Součet X a E, známý jako sterické číslo, je také spojen s celkovým počtem hybridizovaných orbitalů, které používá teorie valenční vazby. VSEPR používá sterické číslo a rozložení X a E k předpovědi geometrických tvarů molekul.

Všimněte si, že geometrie jsou pojmenovány pouze podle polohy atomů, nikoli podle uspořádání elektronů.

Hlavní geometrie (bez osamělých elektronových párů):
V lineárním modelu jsou atomy spojeny v přímce a vazebný úhel je jednoduše geometrický úhel mezi dvěma sousedními vazbami. Jednoduchá trojatomová molekula typu ![]() má své dva vazebné orbitaly vzdálené 180°. Mezi příklady triatomických molekul, pro které teorie VSEPR předpovídá lineární tvar, patří
má své dva vazebné orbitaly vzdálené 180°. Mezi příklady triatomických molekul, pro které teorie VSEPR předpovídá lineární tvar, patří ![]() (která nemá dostatek elektronů, aby vyhovovala pravidlu oktetu) a
(která nemá dostatek elektronů, aby vyhovovala pravidlu oktetu) a ![]() . Při zápisu elektronového bodového vzorce pro oxid uhličitý si všimněte, že vazby C-O jsou dvojné vazby; pro teorii VSEPR to nemá žádný význam. Centrální atom uhlíku je stále spojen s dalšími dvěma atomy. Elektronová mračna, která spojují dva atomy kyslíku, jsou od sebe vzdálena 180°.
. Při zápisu elektronového bodového vzorce pro oxid uhličitý si všimněte, že vazby C-O jsou dvojné vazby; pro teorii VSEPR to nemá žádný význam. Centrální atom uhlíku je stále spojen s dalšími dvěma atomy. Elektronová mračna, která spojují dva atomy kyslíku, jsou od sebe vzdálena 180°.

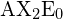 .
. Trigonální planární
Molekuly s trigonálním planárním tvarem jsou trojúhelníkové a v jedné rovině, resp. rovinném povrchu. Molekula ![]() , například
, například ![]() , má tři oblasti elektronové hustoty vycházející z centrálního atomu. Odpuzování mezi nimi bude minimální, když úhel mezi libovolnými dvěma bude 120o.
, má tři oblasti elektronové hustoty vycházející z centrálního atomu. Odpuzování mezi nimi bude minimální, když úhel mezi libovolnými dvěma bude 120o.
Tetrahedrální
Tetra- znamená čtyři a -hedrální se vztahuje k ploše tělesa; „tetrahedrální“ doslova znamená „mající čtyři plochy“. “ Tento tvar se vyskytuje, když jsou čtyři vazby všechny na jednom centrálním atomu, bez osamělých elektronových párů. Podle teorie VSEPR jsou vazebné úhly mezi elektronovými vazbami 109,5o. Příkladem tetraedrické molekuly je metan ![]() . Čtyři ekvivalentní vazby směřují do čtyř geometricky ekvivalentních směrů ve třech rozměrech, což odpovídá čtyřem rohům čtyřstěnu se středem na atomu uhlíku.
. Čtyři ekvivalentní vazby směřují do čtyř geometricky ekvivalentních směrů ve třech rozměrech, což odpovídá čtyřem rohům čtyřstěnu se středem na atomu uhlíku.

Trigonální bipyramidální tvar vzniká, když je centrální atom v molekule obklopen pěti atomy. V této geometrii jsou tři atomy ve stejné rovině s vazebnými úhly 120°; zbylé dva atomy jsou na opačných koncích molekuly. Některé prvky v 15. skupině periodické tabulky tvoří sloučeniny typu ![]() ; příkladem jsou
; příkladem jsou ![]() a
a ![]() .
.

Oktaedrická
Octa- znamená osm a -hedrální se vztahuje ke stěně tělesa, takže „oktaedrická“ doslova znamená „s osmi stěnami“. Všechny vazebné úhly jsou 90°, a stejně jako čtyři elektronové páry zažívají minimální odpuzování, když směřují k rohům čtyřstěnu, šest elektronových párů se snaží směřovat k rohům osmistěnu. Příkladem oktaedrické molekuly (![]() ) je hexafluorid síry (
) je hexafluorid síry (![]() ).
).
https://lab.concord.org/embeddable.html#interactives/jsmol/electron-geometry.json
Interaktivní: Elektronová geometrie: Molekuly nabývají různých tvarů díky vzorcům sdílených a nesdílených elektronů. V těchto příkladech jsou všechny elektrony ovlivňující tvar molekul sdílené v kovalentních vazbách, které drží atomy pohromadě a tvoří molekuly.
Samostatné elektronové páry
Nesdílené elektrony jsou v orbitalech, které zabírají prostor, odpuzují ostatní orbitaly a mění tvar molekuly.
CÍLE UČENÍ
Rozpoznat vliv osamělých elektronových párů na geometrii molekul.
Klíčové body
Klíčové body
- Orbitaly obsahující různé vazebné a nevazebné páry ve valenčním obalu budou vystupovat z centrálního atomu ve směrech, které minimalizují jejich odpuzování.
- Nevazebný orbital nemá na svém vzdáleném konci atomové jádro, které by k němu přitahovalo oblak elektronů; náboj v takovém orbitalu se proto soustředí blíže k centrálnímu atomu.
- Nevazebné orbitaly působí na ostatní orbitaly větším odporem než orbitaly vazebné.
Klíčové pojmy
- koordinační číslo: v chemii a krystalografii počet sousedů centrálního atomu v molekule nebo krystalu
- osamělý pár: Molekulární geometrie s osamělými páry elektronů: valenční soubor dvou elektronů, který existuje bez vazby nebo sdílení s jinými atomy
Molekulární geometrie s osamělými páry elektronů
Dosud jsme se zabývali pouze geometriemi bez osamělých párů elektronů. Jak jste si pravděpodobně všimli v tabulce geometrií a v metodě AXE, přidání osamělých párů mění tvar molekuly. Již dříve jsme se zmínili, že pokud centrální atom obsahuje také jeden nebo více nevazebných párů elektronů, budou se tyto dodatečné oblasti záporného náboje chovat podobně jako oblasti spojené s vázanými atomy. Orbitaly obsahující různé vazebné a nevazebné páry ve valenční slupce budou vystupovat z centrálního atomu ve směrech, které minimalizují jejich vzájemné odpuzování.

Koordinační číslo a centrální atom
Koordinační číslo označuje počet elektronových párů, které obklopují daný atom, často označovaný jako centrální atom. Geometrie molekul s osamělými páry se bude lišit od molekul bez osamělých párů, protože osamělý pár vypadá v molekule jako prázdný prostor. Obě třídy geometrií jsou pojmenovány podle tvarů pomyslných geometrických útvarů (většinou pravidelných plných mnohoúhelníků), které by byly soustředěny na centrální atom a měly v každém vrcholu elektronový pár.
V molekule vody (![]() ) je centrální atom
) je centrální atom ![]() a Lewisův elektronový bodový vzorec předpovídá, že v ní budou dva nevazebné elektronové páry. Atom kyslíku bude tedy tetraedricky koordinovaný, což znamená, že se nachází ve středu tetraedru. Dvě z koordinačních pozic jsou obsazeny sdílenými elektronovými páry, které tvoří vazby O-H, a další dvě nevazebnými páry. Ačkoli je tedy atom kyslíku tetraedricky koordinovaný, vazebná geometrie (tvar) molekuly
a Lewisův elektronový bodový vzorec předpovídá, že v ní budou dva nevazebné elektronové páry. Atom kyslíku bude tedy tetraedricky koordinovaný, což znamená, že se nachází ve středu tetraedru. Dvě z koordinačních pozic jsou obsazeny sdílenými elektronovými páry, které tvoří vazby O-H, a další dvě nevazebnými páry. Ačkoli je tedy atom kyslíku tetraedricky koordinovaný, vazebná geometrie (tvar) molekuly ![]() je popsána jako ohnutá.
je popsána jako ohnutá.

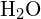 je popsána jako ohnutá.
je popsána jako ohnutá.Odpudivý účinek osamělého páru elektronů
Existuje důležitý rozdíl mezi vazebnými a nevazebnými elektronovými orbitaly. Protože nevazebný orbital nemá na svém vzdáleném konci atomové jádro, které by k němu přitahovalo oblak elektronů, bude náboj v takovém orbitalu soustředěn blíže k centrálnímu atomu; v důsledku toho nevazebné orbitaly působí na ostatní orbitaly více odpudivě než orbitaly vazebné. V ![]() dva nevazebné orbitaly tlačí vazebné orbitaly blíže k sobě, takže úhel H-O-H je 104,5° místo tetraedrického úhlu 109,5°.
dva nevazebné orbitaly tlačí vazebné orbitaly blíže k sobě, takže úhel H-O-H je 104,5° místo tetraedrického úhlu 109,5°.
Elektronově bodová struktura ![]() umisťuje jeden pár nevazebných elektronů do valenční slupky atomu dusíku. To znamená, že kolem dusíku jsou tři vazebné atomy a jeden osamělý pár pro koordinační číslo čtyři, stejné jako se vyskytuje u
umisťuje jeden pár nevazebných elektronů do valenční slupky atomu dusíku. To znamená, že kolem dusíku jsou tři vazebné atomy a jeden osamělý pár pro koordinační číslo čtyři, stejné jako se vyskytuje u ![]() .
.

 .: Osamělý pár připojený k centrálnímu dusíku vytváří vazebné úhly, které se liší od tetraedrických 109,5°.
.: Osamělý pár připojený k centrálnímu dusíku vytváří vazebné úhly, které se liší od tetraedrických 109,5°.Můžeme tedy předpovědět, že tři atomy vodíku budou ležet v rozích tetraedru se středem na atomu dusíku. Orbital osamělého páru bude směřovat ke čtvrtému rohu tetraedru, ale protože tato pozice bude volná, samotná molekula ![]() nemůže být tetraedrická; místo toho nabývá pyramidálního tvaru, přesněji tvaru trigonálního jehlanu (jehlanu s trojúhelníkovou základnou). Všechny atomy vodíku jsou ve stejné rovině, dusík je mimo tuto rovinu. Nevazebné elektrony mírně tlačí vazebné orbitaly k sobě, takže vazebné úhly H-N-H jsou přibližně 107°.
nemůže být tetraedrická; místo toho nabývá pyramidálního tvaru, přesněji tvaru trigonálního jehlanu (jehlanu s trojúhelníkovou základnou). Všechny atomy vodíku jsou ve stejné rovině, dusík je mimo tuto rovinu. Nevazebné elektrony mírně tlačí vazebné orbitaly k sobě, takže vazebné úhly H-N-H jsou přibližně 107°.
V pětikoordinovaných molekulách obsahujících osamělé páry se tyto nevazebné orbitaly (které jsou blíže centrálnímu atomu, a proto je pravděpodobnější, že budou odpuzovány jinými orbitaly) budou přednostně nacházet v ekvatoriální rovině. Díky tomu svírají úhel 90° s nejvýše dvěma axiálně orientovanými vazebnými orbitaly. Můžeme tedy předpovědět, že molekula ![]() (molekula, ve které je centrální atom A koordinován se čtyřmi dalšími atomy X a s jedním nevazebným elektronovým párem), jako je
(molekula, ve které je centrální atom A koordinován se čtyřmi dalšími atomy X a s jedním nevazebným elektronovým párem), jako je ![]() , bude mít tvar „pilové pily“.
, bude mít tvar „pilové pily“.

Záměna nevazebných párů za vázané atomy redukuje trojúhelníkovou bipyramidovou koordinaci na ještě jednodušší molekulové tvary.
https://lab.concord.org/embeddable.html#interactives/jsmol/unshared-electrons.json
Interaktivní: Nesdílené elektrony a „ohnutý“ tvar:
LICENCE A PŘÍSLUŠENSTVÍ
LICENCOVANÝ OBSAH, SDÍLENÝ PŘEDEM
- Curation and Revision. Zajišťuje: Boundless.com. Licence: Blessoundless, s. r. o: CC BY-SA: Teorie: Attribution-ShareAlike
CC LICENCOVANÝ OBSAH, ZVLÁŠTNÍ PŘÍSLUŠENSTVÍ
- VSEPR. Poskytovatel: VŠEOBECNÁ POJIŠŤOVNA, s. r. o: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR_Theory. Licence: CC BY-SA:
- Molekulární geometrie. Poskytuje: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/Molecular_geometry. Licence: CC BY-SA: Uveďte autora-ShareAlike
- Teorie VSEPR. Poskytuje: VSEPR, s. r. o: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licence: CC BY-SA:
- Molekulární geometrie. Poskytuje: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/Molecular_geometry. Licence: Licence: Licence: Licence: Licence: Licence: Licence: Licence: Wikipedie: Licence: Public Domain: VSEPR geometries: VSEPR geometries: VSEPR geometries: No Known Copyright
- VSEPR geometries. Poskytovatelem je: Wikimedia. Nachází se na adrese: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licence: CC BY-SA:
- Jak určit molekulární geometrii – YouTube. Nachází se na adrese: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licence: Public Domain: Žádná známá autorská práva. Licenční podmínky: Standardní licence YouTube
- Linear-3D-balls. Poskytuje: Poskytovatel: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licence: BY:
- Molekulární geometrie. Poskytuje: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/Molecular_geometry. Licence: CC BY-SA: Uveďte autora-ShareAlike
- Teorie VSEPR. Poskytuje: VSEPR, s. r. o: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR_Theory. Licence: CC BY-SA: Uveďte autora-ShareAlike
- Teorie VSEPR. Poskytuje: VSEPR, s. r. o: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR%20Theory. Licence: CC BY-SA:
- Molekulární geometrie. Poskytuje: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/Molecular_geometry. Licence: Public Domain: No Known Copyright
- VSEPR geometries. Poskytovatelem je: Wikimedia. Nachází se na adrese: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licence: CC BY-SA:
- Jak určit molekulární geometrii – YouTube. Nachází se na adrese: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licence: Public Domain: Žádná známá autorská práva. Licenční podmínky: Standardní licence YouTube
- Linear-3D-balls. Poskytuje: Poskytovatel: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licence: BY: Teorie VSEPR: Uveďte autora
- . Poskytl: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metoda. Licence: Public Domain: Teorie VSEPR: Žádná známá autorská práva
- Teorie VSEPR. Poskytovatel: VSEPR, s. r. o: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_metoda. Licence: Public Domain: Žádné známé autorské právo:
- koordinační číslo. Poskytovatelem je: Wikislovník. Nachází se na adrese: http://en.wiktionary.org/wiki/coordination_number. Licence: CC BY-SA:
- John Hutchinson, Concept Development Studies in Chemistry. 18. září 2013. Poskytl: OpenStax CNX. Nachází se na adrese: http://cnx.org/content/m12594/latest/?collection=col10264/latest. Licence: LICENCE: BY: Uveďte autora
- Bez hranic. Poskytl: Boundless Learning. Nachází se na adrese: http://www.boundless.com//chemistry/definition/lone-pair. Licence: CC BY-SA: Uveďte autora-ShareAlike
- Molekulární geometrie. Poskytuje: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/Molecular_geometry. Licence: Public Domain: No Known Copyright
- VSEPR geometries. Poskytovatelem je: Wikimedia. Nachází se na adrese: http://commons.wikimedia.org/wiki/File:VSEPR_geometries.PNG. Licence: CC BY-SA:
- Jak určit molekulární geometrii – YouTube. Nachází se na adrese: http://www.youtube.com/watch?v=pA9ML0HVOYE. Licence: Public Domain: Žádná známá autorská práva. Licenční podmínky: Standardní licence YouTube
- Linear-3D-balls. Poskytuje: Poskytovatel: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/File:Linear-3D-balls.png. Licence: CC BY: Teorie VSEPR: Uveďte autora
- . Poskytl: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licence: Public Domain: Teorie VSEPR: Žádná známá autorská práva
- Teorie VSEPR. Poskytovatel: VSEPR, s. r. o: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR_Theory%23AXE_method. Licence: Public Domain: Teorie VSEPR: Žádná známá autorská práva
- Teorie VSEPR. Poskytovatel: VSEPR, s. r. o: Wikipedie. Nachází se na adrese: http://en.wikipedia.org/wiki/VSEPR_Theory. Licence: Public Domain: Žádná známá autorská práva
- Tetrahedral_Structure_of_Water.png. Poskytovatelem je: Wikimedia. Nachází se na adrese: https://commons.wikimedia.org/wiki/File:Tetrahedral_Structure_of_Water.png. Licence: Public Domain:
chemický model používaný k předpovídání tvaru jednotlivých molekul na základě elektronů.párové elektrostatické odpuzování
celkový počet atomů, které přímo sousedí s centrálním atomem v molekule nebo iontu
dva (pár) valenčních elektronů, které nejsou použity k vytvoření kovalentní vazby