Interaktionen zwischen Gehirn und Gerinnungsprozess haben eine lange Geschichte, einschließlich der Beobachtung, dass der Gerinnungsmechanismus im zentralen Nervensystem eine Reihe von Unterschieden zu dem in anderen Organen aufweist – das Endothel des Gehirns exprimiert zum Beispiel wenig Thrombomodulin.
Was auch immer der Mechanismus ist, es ist schwierig, die Beobachtung zu vermeiden, dass die Behandlung mit Antikoagulation (z.B., mit niedermolekularem Heparin) die Symptome, einschließlich der Migräne, der Gedächtnisstörungen und der Chorea, oft drastisch zurückgehen. Diese Beobachtungen lassen vermuten, dass es sich bei der Hirnpathologie in vielen Fällen nicht so sehr um einen Infarkt handelt, sondern eher um eine „Verschlammung“ der Blutzufuhr und eine beeinträchtigte Sauerstoffversorgung.
Migräne &Schlaganfall
„Haben Sie als Teenager unter Kopfschmerzen gelitten?“
„Ja, Doktor. Eine Zeit lang kamen sie fast wöchentlich. Sie verschwanden für ein paar Jahre, aber jetzt sind sie mit aller Macht zurückgekommen. Sie kommen in meiner Familie vor.“
So spricht die 30-jährige Patientin mit APS (die männlichen Familienmitglieder erscheinen seltener in APS-Kliniken).
Dies ist ein so wichtiger diagnostischer Hinweis bei der Beurteilung eines Patienten mit möglichem APS. Doch trotz der langjährigen Erfahrung mit APS gibt es erstaunlich wenige Daten, die die wahre Rolle von APS in der weiteren Welt der Migräne bewerten. Es gibt so viele Gründe, die Assoziation zu untersuchen – das Ansprechen auf die Antikoagulation – in der Regel gut, oft auffallend -, die Untersuchung von Geschwistern und anderen Familienmitgliedern von Migräne-/APS-Patienten. Und vor allem die Zusammenhänge zwischen Migräne und Schlaganfall, über die jetzt berichtet wird.
APS/Hughes-Syndrom ist in hohem Maße eine neurologische Erkrankung. Die Hirnfunktion scheint besonders betroffen zu sein – je mehr APS-Patienten man sieht, desto breiter & breiten sich die neuropsychiatrischen Wellen aus.
Wie Migräne ist auch der Schlaganfall eine der anerkannten Komplikationen des APS/Hughes-Syndroms. Es wurde berichtet, dass bis zu 1 von 5 jungen Schlaganfallpatienten (unter 45 Jahren) einen positiven aPL-Test aufweisen.14-19
Doch wie bei der Migräne ist die Erkennung von aPL in der Ätiologie des Schlaganfalls im Allgemeinen immer noch schlecht. So ist zum Beispiel der Schlaganfall im Kindesalter – der klinisch gut anerkannt ist – ein Hauptziel für Studien über APL.
Vor einigen Jahren hat die britische Regierung eine große Schlaganfall-Initiative gestartet, um die Öffentlichkeit über die Symptome, Anzeichen und Behandlung von Schlaganfällen aufzuklären. Das Antiphospholipid-Syndrom stand nicht auf der Liste.
Anfälle
Im Jahr 1985 beobachteten wir, dass bei Lupus-Patienten Anfälle häufiger bei Patienten mit positiven APL-Tests auftraten.20 Seitdem ist klar geworden, dass Epilepsie in all ihren Formen eine wichtige Begleiterscheinung von APS ist. So sehr, dass in einer Studie über idiopathische Epilepsie bei Teenagern 1 von 5 positiv auf APL getestet wurde.21

Die Erstuntersuchung durch die Hebamme oder den Geburtshelfer sollte einen einfachen Fragebogen enthalten, um APS auszuschließen.
Image Credit: SPL/Science Source
Die Auswirkungen dieser Beobachtungen sind vielfältig. Lassen Sie mich zwei klinische Beispiele anführen:
Erstens wird die Temporallappenepilepsie bei APS möglicherweise unterschätzt. Eine meiner Patientinnen, eine Frau mit klassischem APS, wurde EEG-Technikerin. Während ihrer Ausbildung benutzte sie vier ihrer Geschwister als Versuchskaninchen. Drei von ihnen hatten eine abnorme Schläfenlappenaktivität. Es ist interessant zu sehen, wie oft eine Epilepsie in der Familienanamnese von Patienten mit APS auftaucht.
Die zweite klinische Anekdote wurde an anderer Stelle veröffentlicht.22 Eine 42-jährige Patientin hatte in der Vergangenheit einen leichten Lupus. Ihr Hauptproblem – und eines mit erheblichen Auswirkungen auf ihr arbeitsreiches Leben – waren jedoch wiederkehrende Anfälle, sowohl Petit-Mal- als auch Grand-Mal-Anfälle, wobei letztere eine fachärztliche Behandlung und die Kombination mehrerer Antiepileptika erforderten. Während ihres Aufenthalts in London entwickelte sie eine tiefe Venenthrombose (es wurde festgestellt, dass sie aPL-positiv war), und es wurde eine routinemäßige Antikoagulation mit Warfarin begonnen. Ein sofortiger und unerwarteter Bonus war eine deutliche Verringerung der Häufigkeit und Schwere der Anfälle, die eine weit weniger aggressive antiepileptische Behandlung erforderten.
‚THE STILLBIRTH SCANDAL: Jeden Tag werden im Vereinigten Königreich bis zu drei Babys tot geboren, die hätten leben können. Eine von 200 Geburten britischer Frauen wird eine Totgeburt sein. Es ist an der Zeit, dass der NHS eine neue Politik und eine neue Haltung einnimmt.‘ -The Times (London), 28. November 2012
Gedächtnisverlust
Die wohl häufigste Erscheinungsform von APS ist Gedächtnisverlust. Oft kommt das Problem erst ans Tageslicht, wenn der Patient nach dem Symptom gefragt wird. So gestehen viele Patienten, dass sie sich Sorgen um Alzheimer machen. Bislang gibt es nur wenige detaillierte klinische Studien. Von Zeit zu Zeit haben wir bei ausgewählten APS-Patienten psychometrische Tests durchgeführt – und die Ergebnisse waren oft überraschend. Dies gilt umso mehr, wenn man bedenkt, dass sich die Gedächtnistests nach Beginn der Antikoagulation auffallend verbessern.23
Multiple Sklerose
Angesichts der ausgeprägten neurologischen Merkmale, einschließlich Sehstörungen und fluktuierender Myelopathie, die bei APS zu beobachten sind, ist es nicht überraschend, dass bei einer Reihe von Fällen die Diagnose MS gestellt wird.24,25
Das Thema ist alles andere als einfach. In der Neurologie wird behauptet, dass positive aPL-Tests manchmal auch bei klassischer MS auftreten. Ich würde es vorziehen, das Bild umzudrehen. Bei diesen Patienten, zumindest bei einigen, kann es sich in erster Linie um APS und in zweiter Linie um MS handeln. Obwohl anekdotisch eine Reihe solcher Fälle auf die Antikoagulation ansprechen, ist die Reaktion bei anderen bestenfalls grenzwertig. Uthman hat kürzlich die recht umfangreiche Literatur zu APS und MS ausgewertet.26
Sonstige neurologische Merkmale
Dazu gehören Gleichgewichtsstörungen (eine Reihe von Fällen, die sich als Meniere-Syndrom darstellen), Chorea (manchmal schwer),27,28 Anosmie, Schlafstörungen (einschließlich Kataplexie und Narkolepsie) und seit kurzem auch autonome Störungen mit einer Reihe von Fällen von POTS (posturales orthostatisches Tachykardiesyndrom).29
Eine der umstrittenen Fragen ist die Prävalenz psychiatrischer Manifestationen.
Ich bin der Meinung, dass eine akute Psychose eher ein Merkmal des Lupus als des APS ist, aber vielleicht liege ich damit falsch. Bei einer meiner Patientinnen, einer Frau mit APS und Zwangsstörung, verbesserte sich die Situation durch die Behandlung mit Antikoagulanzien. Interessanterweise stellte ihr Sohn im Teenageralter, ebenfalls ein Patient mit OCD (und APS-positiv), fest, dass die neuropsychiatrischen Manifestationen weit weniger ausgeprägt waren, als mit der Aspirinbehandlung begonnen wurde.
Nicht das Gehirn
Knochen &Gelenke-Haben Sie irgendwelche Frakturen erlitten? Eine Frage, die vielleicht nicht zur routinemäßigen Anamneseerhebung bei APS-Patienten gehört. Und doch werden spontane Knochenbrüche zunehmend anerkannt, nachdem Dr. Shirish Sangle von 27 spontanen Mittelfußfrakturen bei APS-Patienten berichtet hat.30
Anekdotische Berichte legen nahe, dass (ischämische) Knochenbrüche eine wichtige Manifestation der Krankheit sein können: Mein Kollege, Professor Munther Khamashta, hat einen Hughes-Syndrom-Patienten mit normalen DEXA- und Nebenschilddrüsenwerten, der 57 Spontanfrakturen erlitten hat. Dies ist eindeutig ein wichtiger Bereich für die klinische Forschung.
Auch avaskuläre Nekrose (AVN) und Hüftschmerzen sind bei unseren APS-Patienten keine Seltenheit. Die MRT hat in einigen Fällen eine frühe AVN gezeigt, ohne dass andere Risikofaktoren wie Steroide vorlagen. Mein klinischer Eindruck ist, dass sich die Hüftschmerzen oft bessern, wenn mit Heparin oder Warfarin begonnen wird.
Herz – Ein wichtiges Anliegen ist das Vorhandensein von Angina pectoris und anderen Herzsymptomen bei APS. Trotz einiger früher Berichte über Myokardischämie und Koronarthrombose haben sich erst in den letzten Jahren Veröffentlichungen gehäuft, die eine hohe Häufigkeit dieser Komplikationen aufzeigen.
Zwei Beispiele sind die Untersuchungen von Greco et al, die eine relativ hohe Prävalenz positiver aPL-Tests bei Patienten mit kardialer Ischämie zeigen, und die auffällige Beobachtung, dass Raucherinnen, die die Pille nehmen und aPL-positiv waren, ein 22-faches relatives Risiko für die Entwicklung eines Myokardinfarkts hatten.31,32
Die kardialen Zusammenhänge werden durch den Bericht über eine Assoziation mit dem kardialen Syndrom X, Angina pectoris mit normalen Koronarangiographien, noch verstärkt.33 Es ist anzunehmen, dass aPL-Tests zum Standard in der kardiologischen Klinik werden, insbesondere bei symptomatischen Frauen unter 40 Jahren.
Wie Migräne ist auch der Schlaganfall eine der anerkannten Komplikationen des APS/Hughes-Syndroms. Es wurden Zahlen von bis zu 1 von 5 jungen Schlaganfallpatienten (unter 45) mit positivem aPL-Test berichtet.
GI-Trakt &Leber-Seit wir unsere Beobachtungen zu fokalen stenotischen Läsionen in verschiedenen Arterien, einschließlich Zöliakie- und Mesenterialarterien, gemacht haben, haben wir uns mehr auf Symptome von abdominaler Angina bei Patienten mit aPL/APS konzentriert.34 Dies ist ein schwer zu quantifizierender Zustand, aber wir haben eine Reihe von Fällen gesehen, bei denen Clopidogrel oder Heparin zu einer (manchmal deutlichen) Verbesserung der postprandialen Schmerzen geführt hat.
Obwohl eine Leberbeteiligung bei Lupus selten ist, werden abnorme Leberfunktionstests bei APS häufig beobachtet. Diese können zwar auf eine schwere Leberthrombose hindeuten, wie z. B. das Budd-Chiari-Syndrom oder das HELLP-Syndrom in der Schwangerschaft, das vor einer drohenden katastrophalen APS-Erkrankung warnt, aber in den meisten Fällen haben sie eine gutartige Prognose.35,36
Ein sehr positiver Fallbeispiel: In den frühen 1980er Jahren sah ich ein Mädchen im Teenageralter mit einer tiefen Venenthrombose, positivem aPL und Budd-Chiari-Syndrom.
Prognose schlecht?
Über dreißig Jahre später geht es ihr immer noch gut, da sie von ihren Ärzten in Portugal lebenslang und sorgfältig mit Warfarin behandelt wird.
Goldblatt-Krankheit, die Niere & APS-Nierenarterienstenose, die vor dem Hintergrund ansonsten normaler Arterien auftritt, kann Goldblatts frühe Beobachtungen über die Entwicklung von Bluthochdruck bei Tieren mit experimentell verschlossenen Nierenarterien nachahmen. Die Entdeckung lokalisierter Nierenarterienstenosen durch Sangle führte zu ähnlichen Befunden in anderen Gefäßen, was zu Theorien über lokalisierte thrombotische/endotheliale Pathologie führte.37
Haut: Livedo reticularis, ein Rätsel-Obwohl Hautgeschwüre, dilatierte Venen und subunguale Splitterblutungen bekannte Folgen der Hautthrombose bei APS sind, hat die Livedo reticularis eine Aura des Geheimnisvollen.38,39
Diagnostisch ist das Vorhandensein von Livedo reticularis ein wichtiger Hinweis bei Patienten mit Verdacht auf das Hughes-Syndrom – einschließlich seronegativem APS.
Wenn man sich einige der in diesem Artikel erwähnten Erkrankungen ansieht – MS, Migräne, multiple Frakturen, Gedächtnisprobleme -, fragt man sich, ob das sorgfältige Notieren des Vorhandenseins oder Nichtvorhandenseins von Livedo bei der Differentialdiagnose dieser Erkrankungen von Bedeutung sein könnte.
Eines ist sicher: Das Vorhandensein von Livedo fügt dem Schweregrad des klinischen Bildes eine zusätzliche Dimension hinzu.
Schwangerschaft
Die Schlagzeile des Syndroms ist natürlich die Schwangerschaft, wo die Erfolgsrate gesunder Entbindungen bei aPL-positiven Schwangerschaften von unter 15 % auf über 90 % angestiegen ist. Die Diagnose und Behandlung dieser Fälle war zweifellos ein bedeutender Fortschritt in der Welt der Geburtshilfe.40
Traurigerweise haben wir alle, die wir mit APS arbeiten, aPL-positive Patientinnen betreut (von denen einige frühe Fehlgeburten erlitten hatten), die ein Baby spät in der Schwangerschaft verloren. Totgeburt.
Vor zwei Jahren veröffentlichte die Londoner Times einen Leitartikel mit dem Titel „The Stillbirth Scandal“, in dem sie auf die schlechten Zahlen der Totgeburten in Großbritannien hinwies.41 Doch einige Fälle von Totgeburten bei aPL-positiven Frauen hätten verhindert werden können. So ergab eine aktuelle Studie aus Utah, dass bei aPL-Schwangerschaften die Wahrscheinlichkeit einer Totgeburt um das Drei- bis Fünffache erhöht war.42
Würden routinemäßige aPL-Tests in der Schwangerschaft helfen? Es gelten Kostenerwägungen. Fehlgeburten sind häufig, und es gibt zahlreiche Ursachen. Daher lautet die derzeitige Empfehlung, den Test nur bei Frauen mit drei oder mehr Fehlgeburten durchzuführen. Das scheint hart zu sein. Vielleicht könnte ein einfaches Screening-Verfahren helfen.
Ich habe vorgeschlagen, dass ein Teil des anfänglichen Screenings durch die Hebamme oder den Geburtshelfer einen einfachen dreiteiligen Fragebogen enthalten sollte:
- Hatten Sie eine Thrombose?
- Leiden Sie unter Migräne?
- Haben Sie eine familiäre Vorgeschichte von Autoimmunkrankheiten (d.h., Lupus, RA, Multiple Sklerose, Schilddrüsenerkrankungen)?
Ich bin sicher, dass ein solch einfacher Fragebogen helfen könnte, eine kleine Risikogruppe zu identifizieren.
In den meisten Zentren gibt es keine langfristige Nachsorge, sobald die Mutter und das Baby sicher nach Hause geschickt wurden. Doch oft geben APS-Patientinnen, die beispielsweise im Alter von 40 Jahren mit einem thrombotischen Problem vorstellig werden, eine Fehlgeburt an, die 20 Jahre zurückliegt. In einer idealen Welt hätten Frauen mit wiederholten Fehlgeburten eine regelmäßige langfristige Nachsorge verdient. Aber die Welt ist alles andere als ideal.
Lupus & APS
Die frühen klinischen Studien zu APS wurden in Lupuskliniken durchgeführt und hätten durchaus „Lupusmerkmale“ enthalten können. Es mag überraschen, dass sich im Laufe der Zeit kaum ein Unterschied zwischen primärem APS und dem mit Lupus assoziierten APS gezeigt hat. Zweifellos gibt es einige klassische Lupus-Merkmale (z. B. Libman-Sachs-Endokarditis, Schlaganfall, Krampfanfälle), die eher mit aPL in Verbindung gebracht werden können. Es scheint auch wahrscheinlich, dass eine aPL-Positivität bei Lupus mit einem höheren Chronifizierungsindex einhergeht.
Im Laufe der Zeit wurde auch eine positive Erkenntnis gewonnen: Es ist sehr ungewöhnlich, dass Patienten mit primärem APS in späteren Jahren einen Lupus entwickeln.
Die großen 3
Die Assoziation zwischen Hughes-Syndrom, Sjögren-Syndrom und Schilddrüsenunterfunktion ist so häufig, dass ich sie als die großen 3 bezeichne. Klinisch gesehen handelt es sich um eine wichtige Assoziation, denn die klinischen Symptome der drei Erkrankungen – Müdigkeit, Kreislaufschwäche, Schmerzen und Gleichgewichts- und Gedächtnisstörungen – treten bei allen drei Erkrankungen gemeinsam auf. Ebenso werden viele dieser Patienten mit der Bezeichnung Fibromyalgie belastet.
Jedes der drei zusammenhängenden Syndrome kann gut auf eine Behandlung ansprechen – zum Beispiel das klinische Sjögren-Syndrom auf Hydroxychloroquin und so weiter. Viele dieser Patienten werden mit meinen zwei Bäumen behandelt – Weide (Aspirin) und Chinarinde (Chinin).
Seronegatives APS
Ich glaube, dass einer der Vorteile der Zeit, die ein angehender Kliniker im Labor verbringt, die Erkenntnis ist, dass viele Labortests variieren können. In vielen, vielen Studien wurde versucht, die Bedeutung von Titer, Immunglobulinklasse, Dreifach- oder Doppelpositivität, Relevanz von „anderen“ APL wie Anti-Phosphatidyl-Serin usw. zu bewerten.43,44
Im Großen und Ganzen sind alle diese Faktoren von Bedeutung, aber in der Klinik passen einige nicht, wie z. B. jene Patienten mit allen klinischen Merkmalen von APS, deren APL-Tests hartnäckig negativ bleiben.
Vor einigen Jahren haben wir in einem Artikel den Begriff „seronegatives APS“ eingeführt, um auf Patienten aufmerksam zu machen, die starke klinische Merkmale von APS aufweisen, deren Tests jedoch negativ sind.45 Das Konzept geht auf die Anfänge der seronegativen RA und des seronegativen Lupus zurück – beides Bezeichnungen, die zwar nur auf klinischen Beobachtungen beruhten, aber wichtige therapeutische und prognostische Konsequenzen hatten.
Drei mögliche Erklärungen für seronegatives APS sind: 1) Die Diagnose ist falsch (in allen Fällen unwahrscheinlich); 2) die zuvor positiven Tests sind im Laufe der Zeit negativ geworden (meiner Erfahrung nach selten); oder 3) es sind neue Tests erforderlich.46
Der vielleicht stärkste Grund für Aufgeschlossenheit gegenüber seronegativem APS ergibt sich aus Familienstudien. Vor einigen Wochen sah ich ein eineiiges Zwillingspaar – das erste mit klassischem seropositivem APS, das später seine (absolut) eineiige Zwillingsschwester mitbrachte. Die zweite Zwillingsschwester hatte die gleichen Symptome, aber im Gegensatz zur ersten Zwillingsschwester war ihr aPL-Test negativ. Beide Patienten sprachen auf die Behandlung an.
Einmal im Jahr veranstalten wir in unserem Krankenhaus ein Patiententreffen. Bei dem letzten Treffen haben wir einen einfachen anonymen Fragebogen mit zwei Fragen ausgeteilt: Sind Sie ein Patient mit APS oder ein Freund/Ehepartner? Haben Sie eine enge weibliche Verwandte (Schwester, Mutter, Tante) mit einer Autoimmunerkrankung (z. B. Lupus, RA, Schilddrüse, Multiple Sklerose, APS)? Das Ergebnis: Sechzig Prozent der Patienten hatten eine positive Anamnese von Autoimmunkrankheiten bei nahen Verwandten. Weniger als 20 % der Freunde/Ehepartner antworteten positiv.
Es mag sein, dass meine eigenen Erfahrungen durch die Überweisung von Familienangehörigen von APS-Patienten verzerrt sind – aber ob seropositiv oder nicht, die meisten Patienten mit seronegativem APS sprechen genauso gut auf die Behandlung an.
Wenn einige dieser Personen in der Familienstudie tatsächlich seronegatives APS hatten und dennoch potenziell auf die Behandlung ansprachen, dann sind die Möglichkeiten faszinierend. Vielleicht könnte ein höherer Prozentsatz unserer Migräne-, jungen Schlaganfall- und jungen Angina-Patienten von einer genaueren Untersuchung auf weitere Hinweise auf APS profitieren – zum Beispiel das trockene Schirmer-Syndrom, der Livedo, die familiäre Vorgeschichte von Autoimmunkrankheiten.
Behandlungsaspekte
In vielerlei Hinsicht ist es enttäuschend, zuzugeben, dass es 30 Jahre später nur wenige neue Behandlungsmöglichkeiten gibt. Die Einführung der neuen oralen Antikoagulanzien bei der Behandlung von APS war vorhersehbar zurückhaltend, und es ist noch zu früh, um sie zu verallgemeinern.47
Statine, IVIG und Hydroxychlorquin wurden in die Waagschale geworfen, und natürlich wurde die Anti-B-Zell-Therapie mit positiven Anekdoten bedacht. Eine aktuelle Studie aus Paris legt nahe, dass Sirolimus, das bei Nierentransplantationen eingesetzt wird, eine schützende Wirkung auf die durch APS verursachte Vaskulopathie haben könnte.48
Im Jahr 2016 beschränkt sich die derzeitige Behandlung von APS immer noch weitgehend auf Aspirin, Clopidogrel, Heparin und Warfarin.
Aspirin in niedriger Dosierung ist trotz seiner Kritiker natürlich bei vielen APS-Patienten die erste Wahl. Clopidogrel bleibt jedoch eine nützliche Alternative bei Patienten mit Gastritis oder Asthmatikern. Aber es gibt noch eine dritte Rolle für Clopidogrel – wichtig in der realen Welt der praktischen Medizin -, nämlich bei den Patienten, die, aus welchen Gründen auch immer, Aspirin ausprobiert haben, ohne einen eindeutigen Nutzen zu erzielen.
Heparin – Heparin mit niedrigem Molekulargewicht hat in den meisten Ländern das alte Heparin weitgehend ersetzt, und damit sind auch die Ängste vor Thrombozytopenie und Osteoporose weitgehend verschwunden. Dies ist ein wichtiger Punkt, denn viele Ärzte zögern, die Anwendung von Heparin zu verlängern.
Zwei Beobachtungen: Erstens geht es einer Reihe von Patienten unter Heparin dramatisch besser, während sie sich unter Warfarin weniger wohl fühlen.
Wie geht es weiter? Wenn Dosierungsprobleme, Warfarin-Resistenz und Compliance (hoffentlich) ausgeschlossen sind, besteht eine unmittelbare Option in der vorübergehenden Rückkehr zu Heparin. In einigen Fällen ist aus der vorübergehenden eine halb-lange Behandlung geworden. In unserer APS-Klinik haben wir ein paar Dutzend solcher Patienten, die freiwillig zwei Jahre oder länger auf subkutanem Heparin geblieben sind. Ja, sie haben Blutergüsse bekommen, aber bisher haben wir keine Verschlechterung der DEXA-Scans gesehen.
Die zweite (und sehr klinische) Beobachtung betrifft eine Heparinstudie. Es ist eine regelmäßige Beobachtung, dass aPL/APS-Patientinnen, die während der Schwangerschaft Heparin erhalten, oft acht oder neun Monate lang keine Kopfschmerzen haben. Dies hat uns dazu veranlasst, ein klinisches Instrument zu entwickeln – eine therapeutische Studie, die uns sehr geholfen hat. Dabei handelt es sich um eine drei- oder vierwöchige Behandlung mit LMW-Heparin.49
Lassen Sie mich ein Beispiel für seine Anwendung geben: Bei aPL/APS-Patienten mit zunehmend starken Kopfschmerzen trotz Aspirin/Clopidogrel (und mit einem normalen MRT des Gehirns) kann ein Versuch mit 10.000 Einheiten Dalteparin (oder Enoxaparin) über drei oder vier Wochen beachtliche Ergebnisse erzielen. Erstens kann er einen überraschend klaren Hinweis darauf geben, ob die Antikoagulation der richtige Weg ist. Zweitens kann es für den traumatisierten Patienten, der den bekannten Weg der mehrfachen Facharztkonsultationen mit grenzwertigem klinischem Erfolg beschritten hat, ein wichtiger Wendepunkt sein – das erste spürbare Zeichen der Besserung.
Warfarin – Es gibt wenig Neues über Warfarin zu sagen. Es wurde von den Medien verunglimpft, aber es ist nach wie vor eines der nützlichsten Medikamente in unserem Arsenal. Warfarin schützt, um es einfach auszudrücken, bei APS vor Schlaganfall und Herzinfarkt.
Es wurde bereits erwähnt, dass bei vielen APS-Patienten ein höherer INR-Wert erforderlich ist – insbesondere bei Patienten mit neurologischen Symptomen. Ich bin ein überzeugter Befürworter des Einsatzes von INR-Selbsttestgeräten, wann immer dies bei unseren Patienten möglich ist.
Bedauerlicherweise lehnen einige Kliniken, die Gerinnungshemmer einsetzen, den Einsatz von Selbsttestgeräten ab. Das halte ich für falsch. Schauen Sie sich die Freiheit an, die Selbsttests für insulinabhängige Diabetiker erreicht haben.
Als Ärzte glaube ich, dass wir die Pflicht haben (bis sich bessere, neuere Antikoagulanzien durchsetzen), Warfarin als ein weitgehend sicheres, wirksames Medikament zu unterstützen, das viele Tausende von Leben gerettet hat.
Im Jahr 2015 beschränkt sich die derzeitige Behandlung des Hughes-Syndroms immer noch weitgehend auf Aspirin, Clopidogrel, Heparin & Warfarin.
Mischung
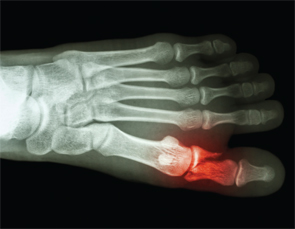
Spontane Knochenbrüche werden zunehmend anerkannt, nachdem Dr. Shirish Sangle über 27 spontane Mittelfußfrakturen bei Aughes-Syndromen berichtet hat. Shirish Sangle über 27 spontane Mittelfußfrakturen bei APS-Patienten berichtet hat.
Bildnachweis: Puwadol Jaturawutthichai/.com
Die Familie: Es überrascht nicht, dass die Familienanamnese ein wichtiger Hinweis auf das Hughes-Syndrom ist. Autoimmunerkrankungen (insbesondere der Schilddrüse) tauchen regelmäßig als Diagnose bei Verwandten unserer Patienten auf. Aber wie oft werden diese Fälle in der Familie diagnostiziert? Beispiele sind die 17-jährige Tochter eines APS-Patienten, die an Kopfschmerzen und Drüsenfieber leidet, das Geschwisterkind mit Multipler Sklerose oder die Mutter und Tante eines neu diagnostizierten APS-Patienten, die mit Anfang 40 einen Schlaganfall erlitten.
Es ist nicht undenkbar, dass APS den Lauf der Geschichte verändert hat, wie in dem Fall, über den mein Freund Dr. Gerald Weissmann, von Königin Anne von England berichtet, die 17 gescheiterte Schwangerschaften hatte und kinderlos starb, was das Ende der Stuart-Herrschaft und den Beginn der Hannoveraner einleitete – mit George III, den Steuern der amerikanischen Kolonien, der Revolution und der Geburt der USA.50
Die Nachkommen – Bislang haben die meisten Studien ergeben, dass die Nachkommen von aPL-positiven Müttern keine größeren negativen Auswirkungen haben (abgesehen vielleicht von den später auftretenden vererbten APS-Merkmalen bei einigen). Einige besorgniserregende Fallberichte über fötale und neonatale Probleme zeigen jedoch, dass weitere Untersuchungen erforderlich sind. Die laufenden Studien von Dr. Anne Parke, Angela Tincani, Maria Claire Boffa und anderen werden mit der Zeit einige dieser fehlenden Daten liefern.51,52
Klassifizierung vs. Diagnose-
Sehr geehrter Herr Doktor, ich wäre Ihnen dankbar, wenn Sie mir einen Rat zu dieser Patientin geben könnten. Sie hat bei der Einnahme der Pille eine Thrombose entwickelt. Sie wurde einmal positiv auf aPL getestet, aber 12 Wochen später nicht mehr.
Wie beim Lupus werden die Klassifizierungskriterien manchmal mit der Diagnose verwechselt. Viele Patienten kommen nicht mit Tests „im Abstand von 12 Wochen“ (dieses Kriterium wurde eingeführt, um das Risiko abzudecken, dass eine zwischenzeitliche Infektion zu einem vorübergehend positiven aPL-Test geführt haben könnte – kein wichtiger Faktor bei unserer Beurteilung dieses Patienten).
Es gibt auch finanzielle Erwägungen, wie in der folgenden Studie aus Beirut, Libanon.
„Nur 50,5% ließen sowohl aCL als auch LA testen. … Die Kosten für jeden Test betrugen etwa 50 US-Dollar für den Patienten. … Es bleibt abzuwarten, ob die Testkosten den sehr geringen Prozentsatz der Patienten, die sich einem Bestätigungstest unterzogen, teilweise erklären.“
Der Lauf der Zeit hat auch eine positive Erkenntnis gebracht: Es ist sehr ungewöhnlich, dass Patienten mit primärem APS in späteren Jahren einen Lupus entwickeln.
Die Anerkennung der vielen nicht-thrombotischen Manifestationen des APS hat dazu beigetragen, dass es wichtig ist, die Diagnose von der Klassifizierung zu trennen. Vielleicht werden uns die Fortschritte im Labor bei der Messung potenzieller Risikomarker mit der Zeit helfen.44
Flugangst – Diese klinische Anekdote taucht regelmäßig in meiner Klinik auf. So häufig, dass ich glaube, dass sie weiter untersucht werden muss. Eine Reihe meiner APS-Patienten leidet, insbesondere vor Beginn der Behandlung, nach einem Langstreckenflug stark unter einem verlängerten Jetlag mit Müdigkeit, Kopfschmerzen und Verwirrung, die manchmal tagelang anhalten.
Interessanterweise verschwindet dieses Phänomen, sobald eine Heparin- oder Warfarin-Behandlung erfolgreich begonnen wurde. Ob diese Symptome auf eine leichte zerebrale Hypoxie zurückzuführen sind, die auf einen leicht reduzierten Kabinendruck zurückzuführen ist, ist nicht bekannt. Nichtsdestotrotz ergänzen einige meiner Patienten mit APS ihre Aspirinbehandlung vor einem Langstreckenflug durch eine Injektion von LMW-Heparin. Obwohl der Placebo-Effekt beträchtlich sein mag, bin ich von der klinischen Erfahrung dieser (aufmerksamen) Patienten ausreichend beeindruckt, um zu glauben, dass das Phänomen des verlängerten Jetlags bei vielen unserer Patienten sehr real ist.
Die Zukunft-Anlässlich des 14. Internationalen Kongresses über Antiphospholipid-Antikörper, der 2013 in Rio de Janeiro stattfand, wurde ich nach meinen Prognosen für die Zukunft des APS gefragt.23 Zusammengefasst glaube ich, dass:
- APL-Tests werden weltweit und routinemäßig eingeführt;
- Freiverkäufliche APL-Testkits werden verfügbar werden;
- Eine beträchtliche Untergruppe von Migränepatienten wird neue Hoffnung haben;
- APS wird als Hauptverbindung zwischen Migräne und Schlaganfall anerkannt werden;
- Herzanfälle bei jungen Frauen (insbesondere bei Frauen unter 45 Jahren) werden reduziert werden;
- Schlaganfälle bei Frauen unter 45 Jahren werden reduziert werden;
- Einige Fälle von akzelerierter Arterienerkrankung werden als mit (unbehandelter) aPL assoziiert erkannt werden;
- Einige Fälle von Gedächtnisverlust sind behandelbar;
- APS wird weiterhin einen tiefgreifenden Einfluss auf unsere klinische Bewertung und Behandlung von Lupus haben; und
- Schließlich, um auf das Eröffnungsthema zurückzukommen, wird die Häufigkeit von Totgeburten zurückgehen, zum Teil dank eines proaktiveren Ansatzes bei aPL-Tests in der Schwangerschaft.
Um einen Satz aus der Arbeit von 1983 zu wiederholen:1
Für diejenigen unter uns, die durch jahrelange Studien über verschiedene Autoantikörper bei SLE in Nihilismus verhärtet sind, gibt es ein seltenes Gefühl der Aufregung angesichts der Auswirkungen der Assoziationen, die jetzt berichtet werden.
Nach dreißig Jahren ist diese klinische Begeisterung ungebrochen.
 Graham R.V. Hughes, MD, FRCP, ist Facharzt für Rheumatologie und Leiter des London Lupus Centre. Er wurde am London Hospital ausgebildet und verbrachte zwei Jahre in New York, wo er unter der Leitung von Dr. Charles Christian an der Einführung des DNA-Bindungstests arbeitete. 1971 eröffnete er in London eine Spezialklinik, die sich ausschließlich mit Lupus und verwandten Krankheiten befasst. Er ist Gründer und Herausgeber der internationalen Zeitschrift Lupus. Im Jahr 1983 beschrieb er das Antiphospholipid-Syndrom und wurde 1991 für diese Arbeit mit dem ILAR-Preis (World Research) ausgezeichnet. Zu seinen weiteren Auszeichnungen gehören der Ehrendoktortitel der Universitäten von Marseille und Barcelona sowie der Master of the ACR.
Graham R.V. Hughes, MD, FRCP, ist Facharzt für Rheumatologie und Leiter des London Lupus Centre. Er wurde am London Hospital ausgebildet und verbrachte zwei Jahre in New York, wo er unter der Leitung von Dr. Charles Christian an der Einführung des DNA-Bindungstests arbeitete. 1971 eröffnete er in London eine Spezialklinik, die sich ausschließlich mit Lupus und verwandten Krankheiten befasst. Er ist Gründer und Herausgeber der internationalen Zeitschrift Lupus. Im Jahr 1983 beschrieb er das Antiphospholipid-Syndrom und wurde 1991 für diese Arbeit mit dem ILAR-Preis (World Research) ausgezeichnet. Zu seinen weiteren Auszeichnungen gehören der Ehrendoktortitel der Universitäten von Marseille und Barcelona sowie der Master of the ACR.
- Hughes GR. Thrombose, Schwangerschaftsabbruch, zerebrale Erkrankungen und das Lupus-Antikoagulans. Br Med J (Clin Res Ed). 1983 Oct 15;287(6399):1088-1089.
- Harris EN, Gharavi AE, Boey ML, et al. Anticardiolipin in antibodies: Nachweis mittels Radioimmunoassay und Zusammenhang mit Thrombose bei SLE. Lancet. 1983 Nov 26;2(8361):1211-1214.
- Boey ML, Colaco CB, Gharavi AE, et al. Thrombosis in SLE: Striking association with the presence of circulating lupus anticoagulant. Br Med J (Clin Res Ed). 1983 Oct 8;287:1021-1023.
- Hughes GR. The Prosser White oration 1983: Bindegewebserkrankungen und die Haut. Clin Exp Dermatol. 1984 Nov;9(6):535-544.
- Asherson RA, Mackworth-Young CG, Boey ML, Hughes GRV. Pulmonale Hypertonie bei systemischem Lupus erythematosus. Br Med J (Clin Res Ed). 1983 Oct 8;287(6398):1024-1025.
- Derue GJ, Englert HJ, Harris EN, et al. Fetal loss in systemic lupus: Assoziation mit Anticardiolipin-Antikörpern. J Obstet Gynaecol. 1985;5(4):207-209.
- Hughes GR, Harris NN, Gharavi AE. Das Anticardiolipin-Syndrom. J Rheumatol. 1986 Jun;13(3):486-489.
- Hughes GR. Hughes‘ syndrome: The anticardiolipin syndrome. A historical view. Lupus. 1998;7 Suppl 2:S1-S4.
- Carecchio M, Cantello R, Comi C. Revisiting the molecular mechanism in antiphospholipid syndrome: Beyond vascular damage. J Immunol Res. 2014;2014:239398.
- Bluestein HG, Zvaifler NJ. Hirnreaktive lymphozytotoxische Antikörper im Serum von Patienten mit SLE. J Clin Invest. 1976 Feb;57(2):509-516.
- Bresnihan B, Oliver N, Grigor R, Hughes GR. Hirnreaktivität von lymphozytotoxischen Anitikörpern bei systemischem Lupus erythematodes mit und ohne zerebrale Beteiligung. Clin Exp Immunol. 1977 Dec;30(3):333-337.
- Bresnihan B, Hohmeister R, Cutting J, et al. The neuropsychiatric disorder in SLE: Evidence for both vascular and immune mechanisms. Ann Rheum Dis. 1979 Aug;38(4):301-306.
- Denburg SD, Behmann SA, Carbotte RM, et al. Lymphocyte antigens in neuropsychiatric systemic lupus erythematosus. Beziehung von Lymphozyten-Antikörper-Spezifitäten zur klinischen Erkrankung. Arthritis Rheum. 1994 Mar;37(3):369-375.
- Harris EN, Gharavi AE, Asherson RA, et al. Cerebral infarction in SLE. Assoziation mit Anticardiolipin-Antikörpern. Clin Exp Rheumatol. 1984 Jan-Mar;2(1):47-51.
- Navarrete MG, Brey RL, Levine SR. „Zerebrale Erkrankungen beim Antiphospholipid-Syndrom“ in Hughes-Syndrom-Antiphospholipid-Syndrom. Khamashta MA, ed. Springer, London: 2000.
- Sanna G, Bertolaccini ML, Cuadrado MJ, et al. Central nervous system involvement in the antiphospholipid (Hughes) syndrome. Rheumatology (Oxford). 2003 Feb;42(2):200-213.
- Etminan M, Takkouche B, Isorna FC, Samii A. Risk of ischaemic stroke in people with migraine: Systemische Überprüfung und Meta-Analyse von Beobachtungsstudien. BMJ. 2005 Jan 8;330(7482):63.
- Nencini P, Baruffi MC, Abbate R, et al. Lupus anticoagulant and anticardiolipin antibodies in young adults with cerebral ischaemia. Stroke. 1992 Feb;23(2):189-193.
- Hughes GR. Antiphospholipid-Syndrom, Migräne und Schlaganfall. Lupus. 2010 Apr;19(5):555-556.
- Mackworth-Young CG, Hughes GR. Epilepsy: Ein frühes Symptom des systemischen Lupus erythematodes. J Neurol Neurosurg Psychiatry. 1985 Feb;48(2):185.
- Cimaz R, Meroni PL, Shoenfeld Y. Epilepsie als Teil des systemischen Lupus erythematodes und des systemischen Antiphospholipid-Syndroms (Hughes-Syndrom). Lupus. 2006;15(4):191-194.
- Hughes GR. „Diplomatische Epilepsie“ in Understanding Hughes Syndrome. Springer-Verlag, London: 2009.
- Hughes GR. Hughes Syndrome/APS. 30 years on, what have we learnt? Eröffnungsvortrag auf dem 14. Internationalen Kongress über Antiphospholipid-Antikörper. Rio de Janeiro, Oktober 2013. Lupus. 2014;23:400-406.
- Cuadrado MJ, Khamashta MA, Ballesteros A, et al. Can neurologic manifestations of Hughes (antiphospholipid) syndrome be distinguished from multiple sclerosis? Analyse von 27 Patienten und Überprüfung der Literatur. Medicine (Baltimore). 2000 Jan;79(1):57-68.
- Hughes GR. Migräne, Gedächtnisverlust und „Multiple Sklerose“. Neurologische Merkmale des Antiphospholipid-Syndroms (Hughes-Syndrom). Postgrad Med J. 2003 Feb;79(928):81-83.
- Uthman I, Noureldine MH, Berjawi A, et al. Hughes syndrome and multiple sclerosis. Lupus. 2015 Feb;24(2):115-121.
- Cervera R, Asherson RA, Font J, et al. Chorea in the antiphospholipid syndrome. Klinische, radiologische und immunologische Merkmale von 50 Patienten aus unserer Klinik und der neueren Literatur. Medicine (Baltimore). 1997 May;76(3):203-212.
- Baizabal-Carvallo JF, Bonnet C, Jankovic J. Movement disorders in systemic lupus erythematosus and the antiphospholipid syndrome. J Neural Transm (Vienna). 2013 Nov;120(11):1579-1589.
- Schofield JR, Blitshteyn S, Shoenfeld Y, et al. Postural tachycardia syndrome (POTS) and other autonomic disorders in antiphospholipid (Hughes) syndrome (APS). Lupus. 2014 Jun;23(7):697-702.
- Sangle S, D’Cruz DP, Khamashta MA, et al. Antiphospholipid-Antikörper, systemischer Lupus erythematodes, und nicht-traumatische Mittelfußfrakturen. Ann Rheum Dis. 2004 Oct;63(10):1241-1243.
- Greco TP1, Conti-Kelly AM, Greco T Jr., et al. Newer antiphospholipid antibodies predict adverse outcomes in patients with acute coronary syndrome. Am J Clin Pathol. 2009 Oct;132(4):613-620.
- Urbanus RT, Siegerink B, Roest M, et al. Antiphospholipid antibodies and risk of myocardial infarction and ischaemic stroke in young women in the RATIO study: A case-control study. Lancet Neurol. 2009 Nov;8(11):998-1005.
- Nair S, Khamashta MA, Hughes GR. Syndrom X und Hughes-Syndrom. Lupus. 2002;11(5):332.
- Sangle SR, Jan W, Lau IS, et al. Coeliac artery stenosis and antiphospholipid (Hughes) syndrome/antiphospholipid antibodies. Clin Exp Rheumatol. 2006 May-Jun;24(3):349.
- Mackworth-Young CG, Melia WM, Harris EN, et al. The Budd-Chiari syndrome. Mögliche pathogenetische Rolle von Anti-Phospholipid-Antikörpern. J Hepatol. 1986;3(1):83-86.
- Hanouna G, Morel N, Le Thi Huong D, et al. Katastrophisches Antiphospholipid-Syndrom und Schwangerschaft: An experience of 13 cases. Rheumatology (Oxford). 2013 Sep;52(9):1635-1641.
- Sangle SR, D’Cruz DP, Jan W, et al. Renal artery stenosis in antiphospholipid syndrome (Hughes) and hypertension. Ann Rheum Dis. 2003 Oct;62(10):999-1002.
- Englert HJ, Loizou S, Derue GG, et al. Clinical and Immunological features of livedo reticularis in lupus. Am J Med. 1989 Oct;87(4):408-410.
- Sangle SR, D’Cruz DP. Livedo reticularis: An enigma. Isr Med Assoc J. 2015 Feb;17(2):104-107.
- Ateka-Barrutia O, Khamashta MA. Die Herausforderung der Schwangerschaft für Patienten mit SLE. Lupus. 2013 Oct;22(12):1295-1308.
- Hughes GR. The stillbirth scandal. Lupus. 2013 Jul;22(8):759-760.
- Silver RM, Parker CB, Reddy UM, et al. Antiphospholipid antibodies in stillbirth. Obstet Gynecol. 2013 Sep;122(3):641-657.
- Rodriguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Clinical manifestations of antiphospholipid syndrome (APS) with and without antiphospholipid antibodies (the so-called ’seronegative APS‘). Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Meroni PL, Chighizab CB, Rovelli F, et al. Antiphospholipid syndrome in 2014: Mehr klinische Manifestationen, neue pathogene Akteure und neue Biomarker. Arthritis Res Ther. 2014;16(2):209.
- Hughes GR, Khamashta MA. Seronegatives Antiphospholipid-Syndrom. Ann Rheum Dis. 2003 Dec;62(12):1127.
- Rodguez-Garcia JL, Bertolaccini ML, Cuadrado MJ, et al. Clinical manifestations of antiphospholipid syndrome (APS) with and without antiphospholipid antibodies. Ann Rheum Dis. 2012 Feb;71(2):242-244.
- Giles I, Khamashta M, D’Cruz D, et al. A new dawn of anticoagulation for patients with antiphospholipid syndrome. Lupus. 2012 Oct;21(12):1263-1265.
- Canuad G, Bienaimé C, Taborin F, et al. Inhibition of the mTORC pathway in the antiphospholipid syndrome. New Eng J Med. 2014 Jul 24;371(4):303-312.
- Hughes GR. Heparin, Antiphospholipid-Antikörper und das Gehirn. Lupus. 2012 Sep;21(10):1039-1040.
- Weissmann G. Queen Anne’s Lupus: Phospholipide und der Verlauf des Reiches. FASEB J. 2014 Apr;28(4):1527-1530.
- Mekinian A, Lachassinne E, Nicaise-Roland P, et al. European registry of babies born to mothers with antiphospholipid syndrome. Ann Rheum Dis. 2013 Feb;72(2):217-222.
- Nalli C, Iodice A, Andreoti L, et al. Children born to SLE and APS mothers. Lupus. 2014 Oct;23(12):1246-1248.
- Major S, Pashayan N, Atweh S, et al. Practice patterns of antiphospholipid syndrome at a tertiary teaching hospital in Lebanon. Lupus. 2002;11(11):759–764.