Kern- und Valenzelektronen
Wenn man auf diese Weise durch das Periodensystem geht und die Elektronenkonfigurationen immer größerer Atome aufschreibt, wird es mühsam, immer wieder die Konfigurationen der gefüllten inneren Unterschalen abzuschreiben. In der Praxis vereinfachen Chemiker die Schreibweise, indem sie ein eingeklammertes Edelgassymbol verwenden, um die Konfiguration des Edelgases aus der vorangegangenen Zeile darzustellen, da alle Orbitale in einem Edelgas gefüllt sind. Zum Beispiel steht das Symbol für die Elektronenkonfiguration 1s2 2s2 2p6 von Neon (Z = 10), so dass die Elektronenkonfiguration von Natrium mit Z = 11, die 1s2 2s2 2p6 3s1 ist, als 3s1
| Vollständige Elektronenkonfiguration | Nobelgas-Kurzschrift | ||
| Neon | Z = 10 | Ne geschrieben: 1s2 2s2 2p6 | Ne: 2s2 2p6 |
| Natrium | Z = 11 |
Na: 1s2 2s2 2p6 3s1 |
Na: 3s1 |
Elektronen in gefüllten inneren Orbitalen sind näher am Kern und enger an ihn gebunden, weshalb sie selten an chemischen Reaktionen beteiligt sind. Wir bezeichnen diese als Kernelektronen. Bei den repräsentativen Elementen (Spalten 1, 2 und 13-18 des Periodensystems) sind die Kernelektronen alle Elektronen mit einem n-Wert, der unter dem maximalen n-Wert der Elektronenkonfiguration liegt. Beim Natriumatom beispielsweise ist der höchste n-Wert 3. Die Kernelektronen sind also die Elektronen in den Atomorbitalen mit n < 3, nämlich die in den 1s, 2s und 2p Orbitalen. Natrium hat also 10 Kernelektronen. Wir werden diese Definition der Kernelektronen später bei den Übergangsmetallen wieder aufgreifen.
Das bedeutet, dass die Chemie eines Atoms hauptsächlich von den Elektronen in seiner äußersten Schale abhängt, denjenigen mit dem höchsten n-Wert, die als Valenzelektronen bezeichnet werden. Die vereinfachte Schreibweise ermöglicht es uns, die Konfiguration der Valenzelektronen leichter zu erkennen. Vergleicht man mit dieser Notation die Elektronenkonfigurationen von Natrium und Lithium, so ergibt sich Folgendes:
| Natrium | 1s2 2s2 2p6 3s1 | 3s1 |
| Lithium | 1s2 2s1 | 2s1 |
Es ist leicht zu erkennen, dass sowohl Natrium als auch Lithium ein s-Elektron in ihrer Valenzschale haben. Wir würden daher vorhersagen, dass Natrium und Lithium eine sehr ähnliche Chemie haben, was auch tatsächlich der Fall ist.
Während wir mit dem Aufbau der acht Elemente der Periode 3 fortfahren, werden die 3s und 3p Orbitale gefüllt, ein Elektron nach dem anderen. Diese Reihe endet mit dem Edelgas Argon, das die Elektronenkonfiguration 3s2 3p6 hat, was einer gefüllten Valenzschale entspricht.
Beispiel 2.2.2
Zeichne ein Orbitaldiagramm und leite daraus die Elektronenkonfiguration von Phosphor, Z = 15, ab. Wie lautet seine Valenzelektronenkonfiguration?
Gegeben: Ordnungszahl
Gefragt: Orbitaldiagramm und Valenzelektronenkonfiguration für Phosphor
Strategie:
- Bestimmen Sie das nächstgelegene Edelgas vor Phosphor im Periodensystem. Subtrahieren Sie dann die Anzahl seiner Elektronen von denen des Phosphors, um die Anzahl der Valenzelektronen des Phosphors zu erhalten.
- Zeichnen Sie unter Bezugnahme auf Abbildung 2.1.1 ein Orbitaldiagramm, um diese Valenzorbitale darzustellen. Ordnen Sie die Valenzelektronen nach der Hund’schen Regel in die verfügbaren Orbitale ein, beginnend mit dem Orbital, das die niedrigste Energie hat. Schreibe die Elektronenkonfiguration aus deinem Orbitaldiagramm auf.
- Ignoriere die inneren Orbitale (diejenigen, die der Elektronenkonfiguration des nächstgelegenen Edelgases entsprechen) und schreibe die Valenzelektronenkonfiguration für Phosphor auf.
Lösung:
A Da Phosphor in der dritten Reihe des Periodensystems steht, wissen wir, dass es eine geschlossene Schale mit 10 Elektronen hat. Wir beginnen, indem wir 10 Elektronen von den 15 Elektronen des Phosphors abziehen.
B Die zusätzlichen fünf Elektronen werden in den nächsten verfügbaren Orbitalen platziert, die laut Abbildung 2.1.1 zeigt, dass es sich um die 3s und 3p Orbitale handelt:
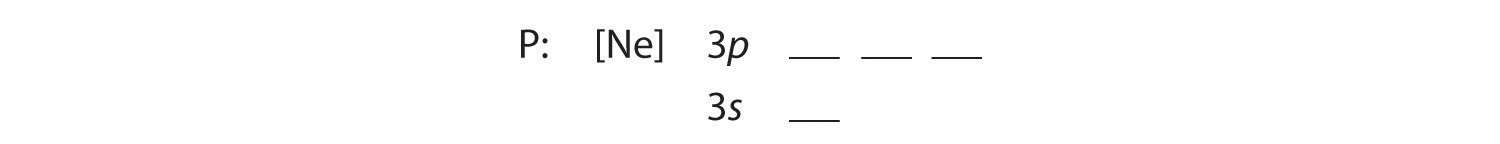
Da das 3s Orbital eine niedrigere Energie hat als die 3p Orbitale, wird es zuerst besetzt:
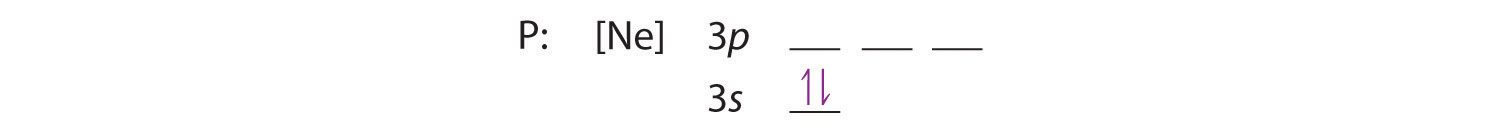
Hunds Regel besagt, dass die verbleibenden drei Elektronen die entarteten 3p-Orbitale getrennt, aber mit gleichgerichteten Spins besetzen werden:
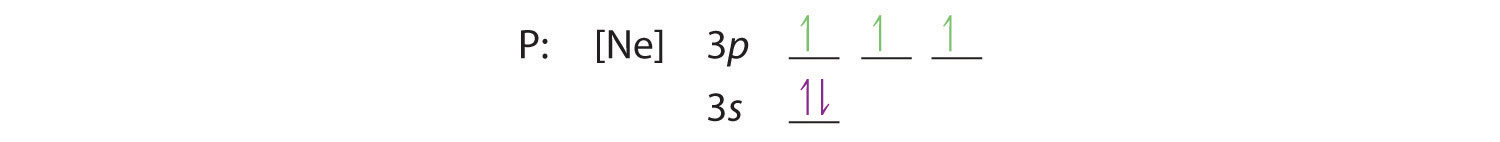
Die Elektronenkonfiguration ist 3s2 3p3.
C Wir erhalten die Valenzelektronenkonfiguration, indem wir die inneren Orbitale ignorieren, was für Phosphor bedeutet, dass wir die geschlossene Schale ignorieren. Dies ergibt eine Valenzelektronenkonfiguration von 3s2 3p3.
Übung 2.2.2
Zeichnen Sie ein Orbitaldiagramm und leiten Sie daraus die Elektronenkonfiguration von Chlor, Z = 17, ab. Wie lautet seine Valenzelektronenkonfiguration?
Antwort: 3s2 3p5
Valenz-Elektronenkonfiguration: 3s23p5
Die allgemeine Reihenfolge, in der Orbitale gefüllt werden, ist in Abbildung 2.2.1 dargestellt. Die Unterschalen, die jedem Wert von n entsprechen, sind von links nach rechts auf aufeinanderfolgenden horizontalen Linien geschrieben, wobei jede Zeile eine Zeile im Periodensystem darstellt. Die Reihenfolge, in der die Orbitale gefüllt werden, wird durch die diagonalen Linien angegeben, die von rechts oben nach links unten verlaufen. Demnach wird das 4s-Orbital aufgrund von Abschirmungs- und Durchdringungseffekten vor dem 3d-Orbital besetzt. Folglich ist die Elektronenkonfiguration von Kalium, mit dem die vierte Periode beginnt, 4s1, und die von Kalzium 4s2. Fünf 3d-Orbitale werden von den nächsten 10 Elementen, den Übergangsmetallen, besetzt, gefolgt von drei 4p-Orbitalen. Das letzte Element in dieser Reihe ist das Edelgas Krypton (Z = 36), Kr: 4s2 3d10 4p6, das gefüllte 4s, 3d und 4p Orbitale hat. Die fünfte Reihe des Periodensystems ist im Wesentlichen die gleiche wie die vierte, außer dass die 5s, 4d und 5p Orbitale nacheinander gefüllt werden.
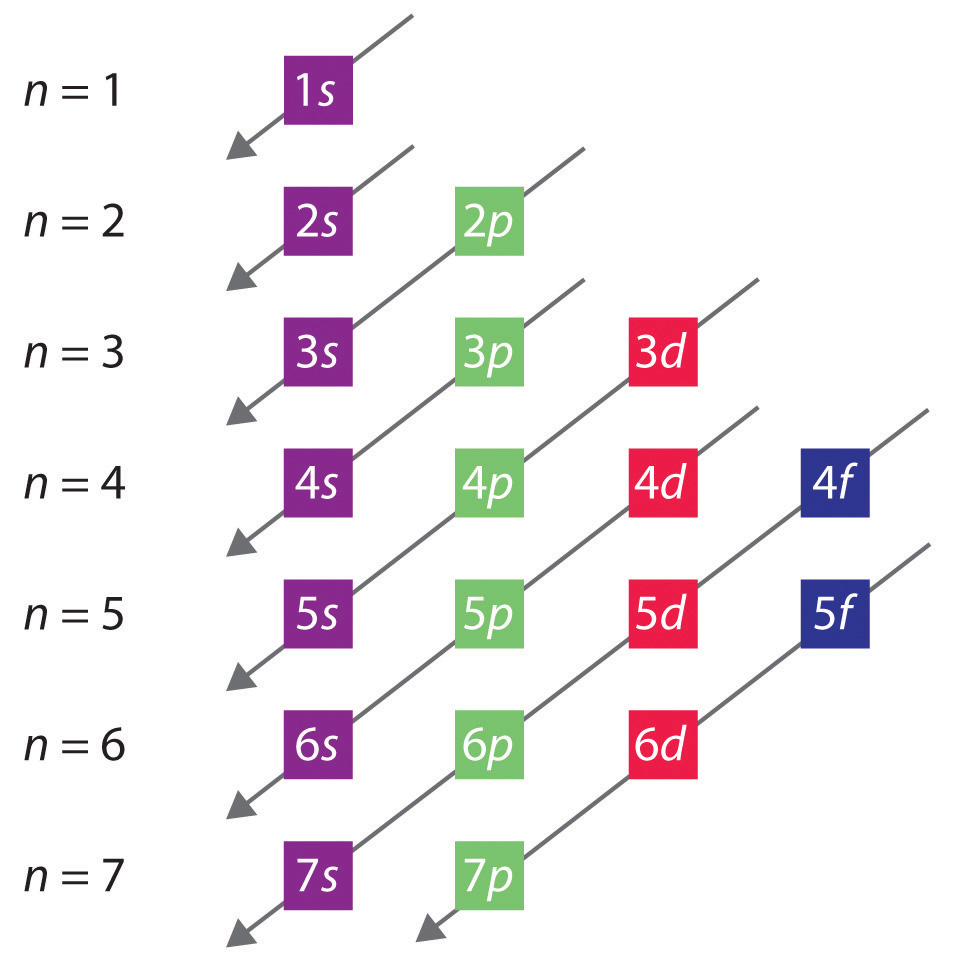
Abbildung 2.2.1 Vorhersage der Reihenfolge, in der die Orbitale in Mehrelektronenatomen gefüllt werden. Wenn man die Unterschalen für jeden Wert der Hauptquantenzahl in aufeinanderfolgende Zeilen schreibt, wird die beobachtete Reihenfolge, in der sie gefüllt werden, durch eine Reihe von diagonalen Linien angezeigt, die von rechts oben nach links unten verlaufen.
Die sechste Zeile des Periodensystems unterscheidet sich von den beiden vorangegangenen, weil die 4f-Orbitale, die 14 Elektronen aufnehmen können, zwischen den 6s und den 5d-Orbitalen gefüllt werden. Die Elemente, die 4f-Orbitale in ihrer Valenzschale enthalten, sind die Lanthaniden. Wenn die 6p-Orbitale schließlich gefüllt sind, haben wir das nächste (und letzte bekannte) Edelgas erreicht, Radon (Z = 86), Rn: 6s2 4f14 5d10 6p6. In der letzten Reihe sind die 5f-Orbitale zwischen den 7s-Orbitalen und den 6d-Orbitalen besetzt, was die 14 Aktiniden ergibt. Da die große Anzahl von Protonen ihre Kerne instabil macht, sind alle Aktiniden radioaktiv.
Beispiel 2.2.3
Schreiben Sie die Elektronenkonfiguration von Quecksilber (Z = 80) und zeigen Sie alle inneren Orbitale.
Gegeben: Ordnungszahl
Gefragt: Vollständige Elektronenkonfiguration
Strategie:
Füllen Sie unter Verwendung des Orbitaldiagramms in Abbildung 2.2.1 und des Periodensystems die Orbitale auf, bis alle 80 Elektronen platziert sind.
Lösung:
Bei der Platzierung der Elektronen in den Orbitalen folgen Sie der Reihenfolge in Abbildung 2.2.1 und unter Verwendung des Periodensystems als Leitfaden, erhalten wir
| 1s2 | Reihe 1 | 2 Elektronen |
| 2s22p6 | Reihe 2 | 8 Elektronen |
| 3s23p6 | Reihe 3 | 8 Elektronen |
| 4s23d104p6 | Reihe 4 | 18 Elektronen |
| 5s24d105p6 | Reihe 5 | 18 Elektronen |
| Reihe 1-5 | 54 Elektronen |
Nach dem Auffüllen der ersten fünf Reihen, müssen wir noch 80 – 54 = 26 Elektronen unterbringen. Gemäß Abbildung 2.2.2 müssen wir die Orbitale 6s (2 Elektronen), 4f (14 Elektronen) und 5d (10 Elektronen) auffüllen. Das Ergebnis ist die Elektronenkonfiguration von Quecksilber:
Hg: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10
Hg: 6s2 4f14 5d10
mit einer gefüllten 5d-Unterschale, einer 6s2 4f14 5d10 Valenzschalenkonfiguration und insgesamt 80 Elektronen. (Sie sollten immer überprüfen, ob die Gesamtzahl der Elektronen der Ordnungszahl entspricht.)
Übung 2.2.3
Obwohl das Element 114 nicht stabil genug ist, um in der Natur vorzukommen, wurden 1999 von einem Team russischer und amerikanischer Wissenschaftler erstmals zwei Isotope des Elements 114 in einem Kernreaktor erzeugt. Gib die vollständige Elektronenkonfiguration für das Element 114 an.
Antwort: 1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d10 6p6 7s2 5f14 6d10 7p2
Die Elektronenkonfigurationen der Elemente sind in Abbildung 2.2.3 dargestellt, in der die Orbitale in der Reihenfolge ihrer Besetzung aufgeführt sind. In mehreren Fällen weichen die Elektronenkonfigurationen im Grundzustand von den in Abbildung 2.2.1 vorausgesagten ab. Einige dieser Anomalien treten auf, wenn die 3d-Orbitale gefüllt werden. Die beobachtete Grundzustandselektronenkonfiguration von Chrom ist zum Beispiel 4s1 3d5 und nicht die vorhergesagte 4s2 3d4. In ähnlicher Weise ist die beobachtete Elektronenkonfiguration von Kupfer 4s1 3d10 anstelle von s2 3d9. Die tatsächliche Elektronenkonfiguration lässt sich durch eine zusätzliche Stabilität erklären, die mit einer halbgefüllten (ns1, np3, nd5, nf7) oder gefüllten (ns2, np6, nd10, nf14) Unterschale verbunden ist. Angesichts der geringen Unterschiede zwischen höheren Energieniveaus reicht diese zusätzliche Stabilität aus, um ein Elektron von einem Orbital in ein anderes zu verschieben. Bei schwereren Elementen können auch andere, komplexere Effekte eine Rolle spielen, die zu einigen der in Abbildung 2.2.3 dargestellten zusätzlichen Anomalien führen. Zum Beispiel hat Cer eine Elektronenkonfiguration von 6s2 4f1 5d1, die sich nicht mit einfachen Worten erklären lässt. In den meisten Fällen haben diese offensichtlichen Anomalien jedoch keine wichtigen chemischen Konsequenzen.
Anmerkung
Zusätzliche Stabilität ist mit halbgefüllten oder gefüllten Unterschalen verbunden.